
Para aqueles que não sabem, o CTD (do inglês Common Technical Document) – Documentação técnica comum – está sendo discutido e será a nova forma de avaliar as documentações necessárias, principalmente com relação às IFAs, para o registro e pós-registro de medicamentos na ANVISA.
A ANVISA, como forma de orientar os profissionais da área, lançou a primeira versão do Guia em 14/08/2019. O prazo para as contribuições iniciou-se em 19/09/2019, sendo a data de encerramento previsto para a próxima sexta-feira, dia 14/2.
Guia CTD 24/2019
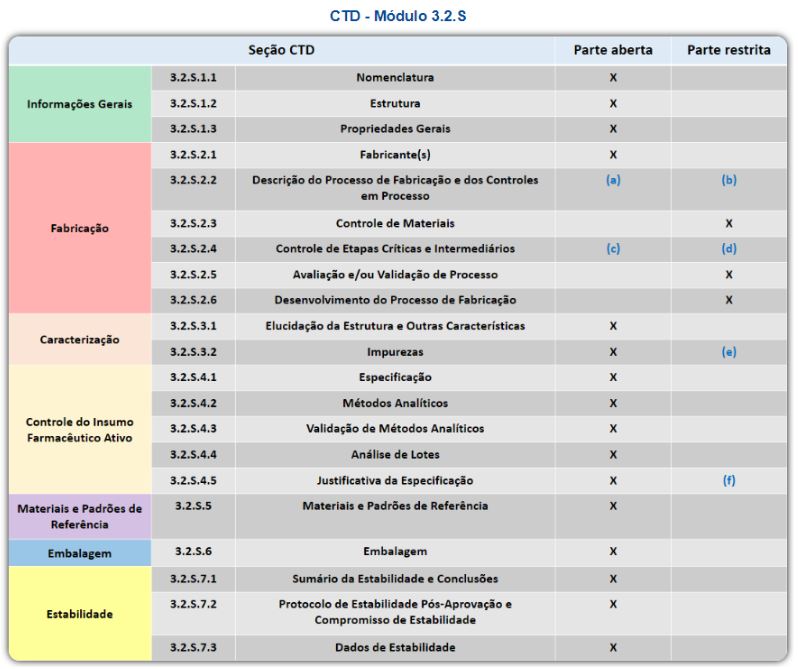
O Guia 24/2019 – GUIA PARA ORGANIZAÇÃO DO DOCUMENTO TÉCNICO COMUM (CTD) PARA O REGISTRO E PÓS- REGISTRO DE MEDICAMENTOS discorre sobre a organização do Documento Técnico Comum, o CTD para registro e pós-registro de medicamentos. Este Guia de CTD expressa o entendimento da Anvisa sobre as melhores práticas com relação a procedimentos, rotinas e métodos considerados adequados ao cumprimento de requisitos técnicos ou administrativos exigidos pelos marcos legislativo e regulatório da Agência.
Trata-se de um instrumento não normativo, de caráter recomendatório. Ou seja, a inobservância de seu conteúdo não caracteriza infração sanitária nem é motivo para indeferimento de petições, desde que atendidos os requisitos exigidos pela legislação.
O Guia de CTD aborda a organização da informação a ser apresentada em requisições de registro e pós-registro de medicamentos novos, inovadores, biológicos, genéricos, similares, radiofármacos, específicos e fitoterápicos. O guia em si não pretende indicar quais estudos e requisitos técnicos são necessários. Ele apenas indica o formato e organização adequados para os dados que foram gerados e que são exigidos nas legislações específicas.
Envio de sugestões do CTD para a ANVISA
Os interessados em encaminhar sugestões para o Guia CTD 24/2019 devem acessar o formulário eletrônico específico. As contribuições recebidas serão avaliadas e poderão subsidiar a revisão do documento e, se for o caso, a publicação de uma nova versão.
Referências
- ANVISA
- CTD




