A Agência Nacional de Vigilância Sanitária (ANVISA) e a Coordenação do Comitê Gestor da Implantação do Sistema Nacional de Controle de Medicamentos – SNCM publicaram na última semana a NOTA TÉCNICA Nº 01/2015 em esclarecimento às principais dúvidas a cerca do processo de implantação e respectivos testes da RDC 54/2013.
As informações publicadas tem como finalidade indicar critérios, parâmetros técnicos e operacionais para implantação do Sistema, nos moldes estabelecidos na RDC nº 54/2015. Além disso, a Anvisa tem como intuito ajudar na elaboração de documentos de orientação pertinentes ao SNCM, visto o grande número de questionamentos gerados a cerca do assunto.
Aliás, algumas dúvidas, perguntas e respostas já haviam sido expostas no artigo
Serialização e rastreabilidade – Estratégias para a implementação do sistema e adequação à RDC nº54 de 2013.
Mas ainda há muito o que ser esclarecido, e por este motivo que a Agência publicou esta nota técnica nº 01/2015:
Principais pontos da NOTA TÉCNICA Nº 01/2015 sobre Serialização e Rastreabilidade – RDC nº 54/2013
I. PRODUTOS IMPORTADOS SERIALIZADOS
1) Conferência do IUM
A conferência do IUM – Identificador Único de Medicamentos – poderá ser feita no local de armazenamento no detentor do registro, contudo este já deverá possuir as informações dos IUMs remetidos por embarque, oriundas do fabricante no exterior. A RDC nº 54/2013 estabelece que as embalagens de transporte deverão conter código identificador relacionando todos os IUMs que contém a embalagem.
2) Produtos importados serializados
Os produtos importados serializados já deverão vir agregados quando de sua importação. O parágrafo 2º do artigo 9º da RDC Nº 54/2013 estabelece que as embalagens de transporte deverão conter um código identificador no qual estejam relacionados todos os IUM que compõem a embalagem. Isso garante o conhecimento dos IUMs desde a origem.
3) Datamatrix dos produtos importados serializados
Para produtos importados serializados, o Datamatrix já deverá, constar na embalagem secundária dos medicamentos importados acabados. A empresa fabricante e importadora deverão se adequar às regras do Brasil para esta importação. A RDC nº 54/2013 estabelece que a aposição, inscrição ou inclusão do código de barras bidimensional (Datamatrix) nas embalagens de comercialização de medicamentos fica a cargo das empresas detentoras de registro de medicamentos, conforme regulamentos e normas técnicas específicas vigentes. Esse dispositivo normativo não restringe, portanto, a modalidade de aposição, inscrição ou inclusão do código, desde que observados os padrões técnicos e normativos vigentes.
II. PRODUTOS IMPORTADOS NÃO SERIALIZADOS
1) Posicionamento da ANVISA
A ANVISA estuda a possibilidade de que seja facultada a serialização e agregação em território nacional, desde que observados a legislação e normativos vigentes.
III. TEMPO REAL
1) Comunicação entre elos da cadeia do medicamento
Os sistemas devem prover a comunicação dos eventos em concomitância ao seu lançamento disponibilizando-os em tempo real aos respectivos elos, conforme disposto na RDC 54/2013.
IV. ADEQUAÇÃO DE LINHAS PRODUTIVAS
1) Aquisição de equipamentos de Serialização para linhas de embalagem
A adequação da linha de produção para permitir a serialização na embalagem secundária deverá ser uma notificação de implementação imediata. Será criado código de assunto para esta adequação.
V. DISPENSAÇÃO
1) Cadeia do medicamento: fabricante – drogarias/hospitais/farmácias
A RDC nº 54/2013 estabelece que o rastreamento do ponto de vista do detentor de registro (fabricante ou importador) se dará até a entrada na unidade de dispensação (farmácia, drogaria e hospitais). Isso resultará em registro do evento de baixa/dispensação no banco de dados das unidades de dispensação, não sendo este evento comunicado aos elos anteriores.
[quote_center]Nota: As drogarias, hospitais, e farmácias também deverão adquirir equipamentos que permitam a leitura e envio da informação de baixa para a nuvem da ANVISA.[/quote_center]
Tipos de equipamentos a serem adquiridos:
- Distribuidoras: Servidor Repositório e equipamentos e sistemas capazes de realizar o recebimento, gerenciamento da unidade, retrabalho, envio, recolhimento e destruição. Leitores portáteis. Ex: Soluções da ROC IT® http://www.rocitsolutions.com/
- Drogarias: Servidor Repositório e leitores manuais;
- Farmácias on-line: Servidor Repositório e leitores manuais;
2) Comunicação dos dados à ANVISA
A IN nº 6/2014 previu eventos em todo o escopo do SNCM, quando, futuramente, os dados pertinentes à dispensação deverão ser comunicados à ANVISA por meio de interfaces de acesso remoto.
VI. EMBALAGENS
1) Gravação dos dados
Não há restrições para a opção de que o número de registro (MS) e nº GTIN na forma humano legível sejam impressos no cartucho, desde a gráfica. A gravação humano legível posterior dos dados variáveis do IUM deverá abranger:
- Número serial;
- Data de validade
- Número do lote
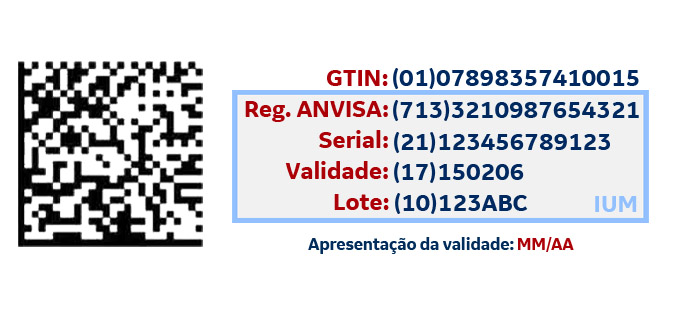
O código bidimensional Datamatrix deverá obrigatoriamente conter:
- Número de registro do medicamento junto à Anvisa
- Número serial
- Data de validade
- Número do lote
2) Embalagem do medicamento e a ANVISA
O envio da nova embalagem à Anvisa será SEMPRE necessário. No entanto, se for apenas para tratar de inclusão do Datamatrix, será considerado apenas notificação, enquanto em qualquer situação em que se tenha uma ALTERAÇÃO do layout há necessidade de autorização.
3) Alteração de rótulo
Serão passíveis de implementação imediata com envio da nova rotulagem, via petição de “Notificação de Alteração de Rotulagem”, as seguintes alterações:
- Inclusão do código bidimensional;
- Retirada do código de Barras GTIN;
- Retirada da tinta reativa (raspadinha).
- Alterações de “layout”, para inclusão do código bidimensional sem que haja prejuízo da disponibilização das demais informações previstas na legislação vigente para rotulagem de medicamentos:
a. Cor;
b. Fonte;
c. Tamanho e dimensões da rotulagem;
d. Diagramação das informações, incluindo alteração da direção do texto;
e. Alteração, inclusão ou exclusão dos elementos gráficos de que trata o art. 17 da Resolução RDC nº 71, de 22 de dezembro de 2009;
4) Tinta reativa (raspadinha)
A tinta reativa (raspadinha), de acordo com Art. 22 e 23 da RDC nº 71/2009, é considerada item facultativo nas embalagens desde que haja mecanismos de identificação e segurança que possibilitem o rastreamento do produto.
[quote_center]A ANVISA considera a tinta reativa um dispositivo de autenticidade importante.[/quote_center]
5) Datamatrix
A impressão das informações do código 2D em dados humano legíveis deverão ocorrer dispostas em ordem e localização que permita a identificação clara do IUM pelo usuário.
VII. IUM
1) IUM
Deverá ser mantida ordem de caracteres que permita a identificação clara do IUM pelo usuário. O número serial deve ser inscrito de forma legível a olho humano preferencialmente em uma única linha e em conformidade aos padrões técnicos aplicáveis.
VIII. RELATÓRIOS DE RASTREABILIDADE COMPLETA – 3 LOTES
1) Teste de rastreamento
A RDC nº 54/2013 especifica que as empresas detentoras de registro deverão disponibilizar à Anvisa os dados de rastreamento completo de 3 lotes até as unidades de dispensação, asseguradas as interfaces de acesso remoto à Anvisa. A simples disponibilização de arquivos XML não atende à RDC nº 54/2013, pois não assegura a existência das interfaces de acesso remoto à Anvisa, tampouco a manutenção do fluxo em tempo real de informações que garantam o disposto nos artigos 16,17 e 18 da referida norma.
IX. PRAZOS NORMATIVOS
1) Prazo a adequação da cadeia
Toda a cadeia deverá estar preparada para cumprir a legislação nos prazos estabelecidos.
2) Impressão do código antes do prazo estalecido pela ANVISA
Não há impedimentos para a impressão do código antes do prazo previsto. Lembrando que, independente da impressão do código antes do prazo definido, a empresa deverá continuar a cumprir todos os requisitos de rotulagem já estabelecidos na legislação atual.
3) Prazo máximo
Para todos os medicamentos comercializados e distribuídos no país, nos termos do artigo 3º da RDC nº 54/2013, a implantação do SNCM deverá ocorrer no prazo máximo de 3 (três) anos (dezembro de 2016) a contar da data de sua publicação. (RDC nº 54/2013 – publicação no Diário Oficial da União em 11/12/2013).
4) Medicamentos produzidos antes vigência da RDC nº 54/2013
Os medicamentos que foram produzidos anteriormente a data de vigência da nova norma estavam adequados à legislação vigente à época da fabricação, e podem ser comercializados até o fim de seu prazo de validade.
X. TRANSFERÊNCIA DE TITULARIDADE
1) Responsabilidades
A empresa sucessora tem a responsabilidade legal sobre a rastreabilidade dos medicamentos no processo de transferência de titularidade. No âmbito do SNCM, conforme as disposições da RDC nº 54/2013, o rastreamento dos medicamentos se dará por meio do registro de todas as movimentações do IUM na cadeia dos produtos farmacêuticos, devendo as informações dos CNPJ das empresas ou estabelecimentos remetentes e receptores, bem como das transportadoras, quando aplicável, serem registradas nos bancos de dados dos elos da cadeia. No que se refere à transferência de titularidade, desde a inscrição na junta comercial até a publicação da alteração de titularidade, não há óbice que haja comercialização do produto da sucedida pela sucessora. Todas as atividades produtivas, inclusive a serialização, são de responsabilidade da sucessora na forma concedida pela Anvisa à antecessora, conforme regulamentação em vigor.
Dúvidas
Apesar da publicação da notificação 01/2015 acima descrita e comentada, ainda restam muitas dúvidas e pontos ainda não esclarecidos pela ANVISA sobre a sistemática de serialização e rastreabilidade da RDC nº 54/2013.
Vamos aguardar novas informações e orientação da Agência.
Enquanto isso, há muito trabalho a ser feito…
Referências
RDC nº 54 de 2013 -ANVISA
IN 06/2014 – ANVISA