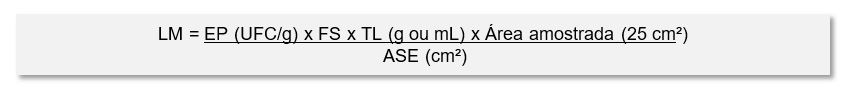Para quem atua no mercado com Validação encontra por meio de Guias Nacionais e internacionais, e artigos científicos, diversas opções de cálculos na Validação de Limpeza para determinar o limite do residual (ativo e detergente). Mas na rotina qual o cálculo mais indicado?
Ou somente o cálculo da ANVISA é o mais correto?
Devemos esquecer os demais?
Para entender melhor cada um deles e suas “pegadinhas”, trouxe aqui algumas orientações sobre os cálculos da Validação de Limpeza:
CONSIDERAÇÕES DO ESTUDO DE VALIDAÇÃO DE LIMPEZA X REFERÊNCIAS BIBLIOGRÁFICAS
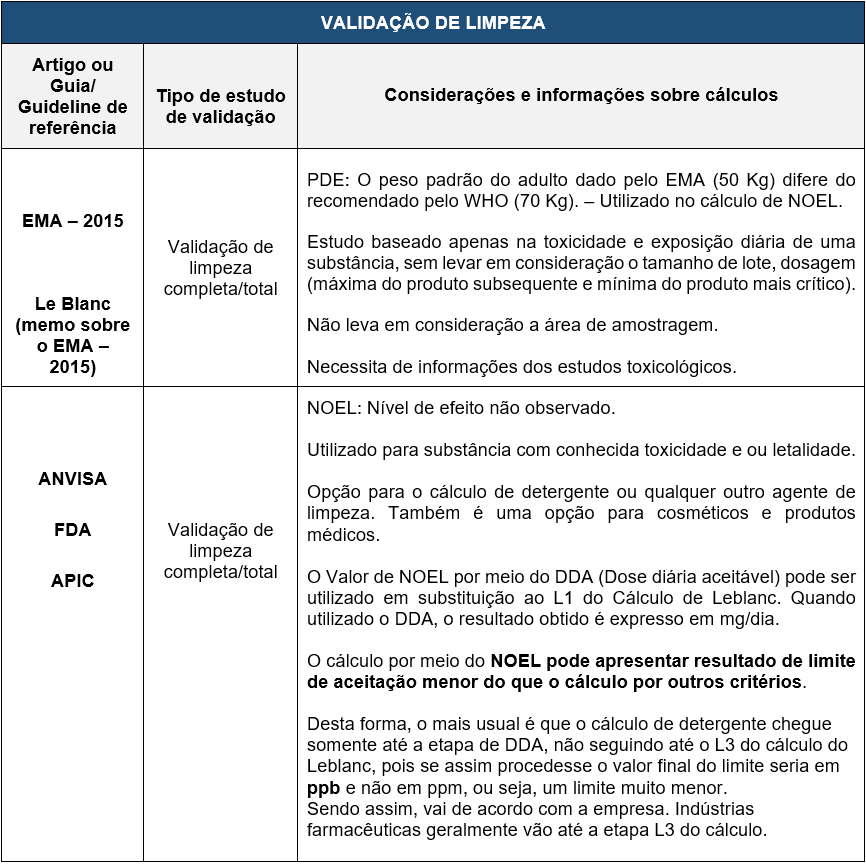
No quadro abaixo fiz um comparativo entre os diversos cálculos utilizados na validação de limpeza fazendo uma referência direta aos guias relacionados.
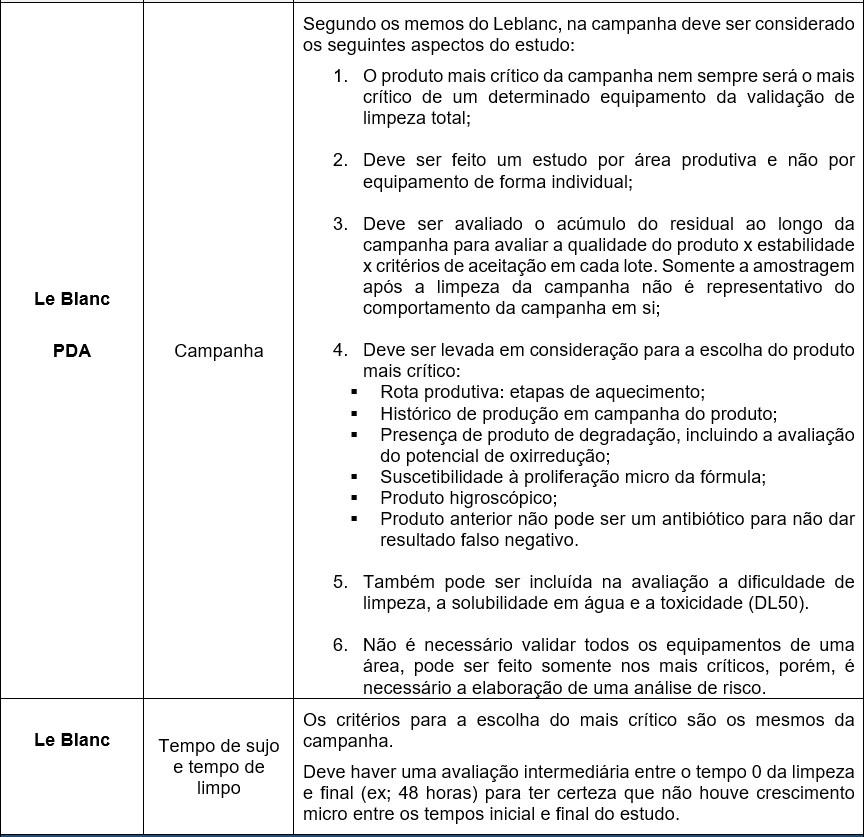
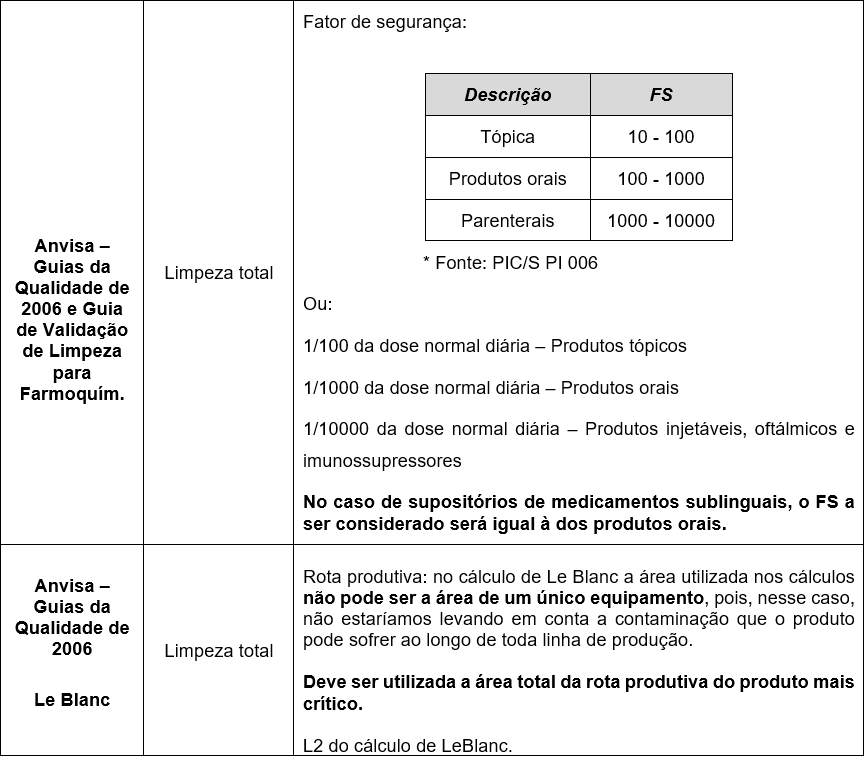
Em cada um dos guias, ou tipo de validação, existem aspectos importantes que devem ser considerados:
CÁLCULOS DA VALIDAÇÃO DE LIMPEZA
Para entender um pouco mais sobre os cálculos descritos acima:
PDE

O PDE representa uma dose específica de uma substância que improvavelmente causaria um efeito adverso em um indivíduo quando exposto à uma dose abaixo desta diariamente por toda a sua vida.
Cálculo do PDE: Permitted Daily Exposure
Onde:
PDE – Exposição diária permitida
NOAEL – Nível de efeito adverso não observado (mg/Kg de peso/dia) – estudos de toxicidade
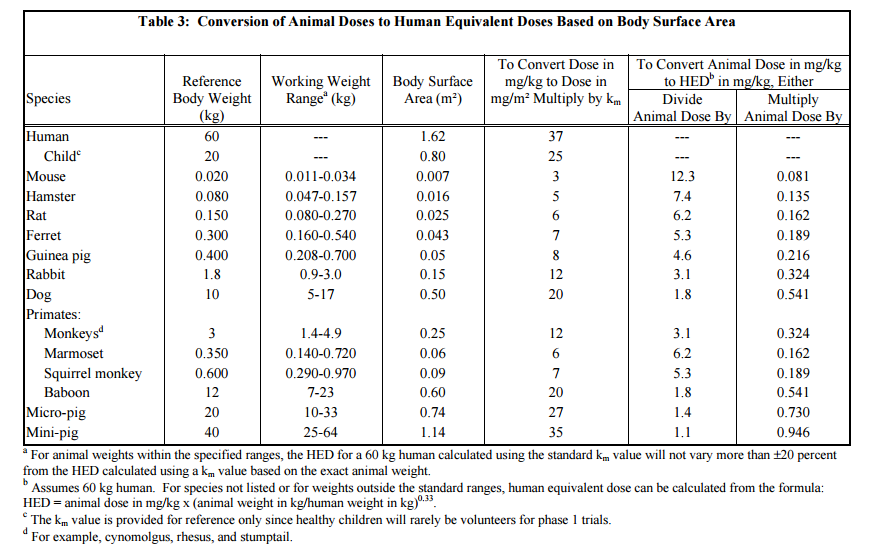
Quando o cálculo for em humanos extrapolar o valor por meio do cálculo de HED.
Peso padrão do humano – 50 Kg
Peso padrão do animal – 1 Kg
F: Fator de incerteza (ajuste)
A unidade expressa para o PDE é mg/dia e não ppm!
A empresa deve fazer a conversão para ppm.
A questão deste cálculo é que somente leva em consideração a toxicidade do ativo, e não os aspectos produtivos relacionados ao produto.
Pode ser calculado apenas por toxicologistas.
PDE: FATOR
F1: Fator (valores entre 2 e 12) – para levar em conta a extrapolação entre espécies com relação à comparação da área de superfície corpórea de um humano.
F1 = 1 para dados humanos
F1 = 5 para extrapolação de ratos para humanos
F1 = 12 para extrapolação de camundongo para humanos
F1 = 2 para extrapolação de cães para humanos
F1 = 2.5 para extrapolação de coelhos para humanos
F1 = 3 para extrapolação de macacos para humanos
F1 = 10 para extrapolação de outros animais para humanos
F2: Fator para explicar a variabilidade entre os indivíduos. Geralmente utiliza-se 10.
F3: Fator para ser levado em consideração em estudos de toxicidade de curta duração
F3 = 1 para estudos de pelo menos meio tempo de vida de duração (1 ano para roedores ou ratos; 7 anos para gatos, cachorros e macacos)
F3 = 1 para estudos de reprodução no qual todo o período de organogêneses foi coberto.
F3 = 2 para 6 – 9 meses de estudos em roedores ou 3.5 anos de estudo em não roedores
F3 = 5 para meses de estudos em roedores ou 2 anos de estudo em não roedores
F3 = 10 para estudos de curta duração (menos de 4 semanas ) em qualquer caso.
F4: Fator (1-10) que pode ser aplicada nos casos de toxicidade grave. Ex: não genotóxico de carcinogenicidade, neurotoxicidade ou teratogenicidade.
Em estudos de toxicidade reprodutiva utilizar:
F4 = 1 para toxicidade fetal associada com a toxicidade materna.
F4 = 5 para toxicidade fetal sem toxicidade materna.
F4 = 5 para o efeito de teratogenicidade associada com a toxicidade materna.
F4 = 10 para o efeito de teratogenicidade sem toxicidade materna.
F5: Fator variável que pode ser aplicado se o nível sem efeito não observado (NOEL) não foi estabelecido.
F5 = 1 para o uso do valor de NOEL
F5 = 1-5 para o uso do valor de NOAEL
F5 = 5-10 para o uso do valor de LOEL
Quando apenas um LOEL está disponível, um fator de até 10 poderia ser utilizado dependendo da gravidade da toxicidade
F5 = 10 para o menor efeito adverso observado (observed-adverse-effect level – LOAEL)
NOAEL
Para todos os efeitos adversos identificados deve ser estabelecido O NOAEL.
O NOAEL é a dose mais elevada testada no qual nenhum efeito “crítico” é observado. É baseado em efeitos farmacodinâmicos clínicos.
Caso o efeito adverso seja observado em vários estudos em animais, o NOAEL na dose mais baixa deve ser utilizado para o cálculo do valor de PDE. Porém, se nenhum NOAEL é obtido, pode ser utilizado o nível de efeito adverso mais baixo observado (LOAEL).
O NOAEL não é o mesmo que o nível sem efeitos observáveis (NOEL).
O NOAEL, em comparação com o NOEL, reflete o ponto de vista de que alguns efeitos observados no animal pode ser ações farmacodinâmicas aceitáveis da terapêutica e não pode levantar uma preocupação em termos de segurança.
O NOAEL também não deve ser confundido com o nível mais baixo efeito adverso observado (LOAEL) ou a dose máxima tolerada (MTD). Ambos são baseados em resultados de efeitos adversos e geralmente não usados como pontos de referência para o estabelecimento de doses iniciais seguras em voluntários adultos saudáveis.
(O termo refere-se ao nível de dose ou dosagem, geralmente expresso como mg / kg ou mg / kg / dia).
*FDA – Pharmacology and Toxicology – Guidance for Industry Estimating the Maximum Safe Starting Dose in Initial Clinical Trials for Therapeutics in Adult Healthy Volunteers –2005
*FDA – Pharmacology and Toxicology – Guidance for Industry Estimating the Maximum Safe Starting Dose in Initial Clinical Trials for Therapeutics in Adult Healthy Volunteers –2005
NOEL
Os Limites de Aceitação, neste caso, serão definidos através dos cálculos de NOEL e DDA, ou seja, os cálculos serão baseados na toxicidade do agente de limpeza ou do produto cosmético.
Os Limites de Aceitação serão definidos através dos cálculos descritos abaixo:
Cálculo do NOEL (Nível de Efeito Não Observado): determina a concentração segura do total de resíduos do agente de limpeza ou do produto cosmético.
Dose Diária Aceitável (DDA ou ADI): deriva do valor de NOEL, o qual é multiplicado pelo peso padrão de um humano adulto (AAW = 70kg) e pelo fator de segurança (FS = 0,001 – via oral) em estudo.
Ou conforme disposto na fórmula do Guias da Garantia da Qualidade de 2006 – ANVISA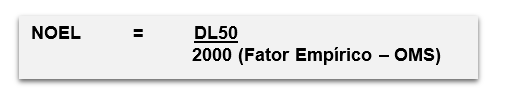
Em ambos os casos o valor obtido de NOEL será o mesmo.
O valor expresso será em mg/dia.
Para chegar ao valor em ppm o DDA deve ser dividido pela máxima dose diária do produto B.
Cálculo do limite final
Onde:
Limite – limite a ser encontrado do residual do agente de limpeza em ppm
1000 – Conversão de mg para µg
DMDS – Máxima dose diária do produto subsequente (B) em g ou ml – É DO PRODUTO E NÃO DO ATIVO!
O resultado final será expresso em µg/g = ppm
Geralmente, o cálculo para aqui porque o valor, caso ele venha a substituir o L1, poderá ter um limite muito baixo.
*Opção de L3 para amostragem por rinsagem
*Opção de L3 para amostragem por swab
Cálculo da Rinsagem
Muitos acreditam que o cálculo aplicado para amostragem por swab pode ser utilizado para a amostragem por rinsagem, mas não é bem assim.
A partir de agora vou mostrar as opções de cálculo da validação de limpeza exclusivo para amostragem indireta – rinsagem:
Guia de validação de limpeza para farmoquímico – ANVISA E APIC
Este Guia da Anvisa é praticamente uma tradução do Guia do APIC. Nele constam os seguintes cálculos:
Quantidade de resíduo no equipamento limpo por enxágue
M = V*(C – CB)
Onde:
M – Quantidade de resíduo no equipamento limpo (mg)
V – Volume da última porção de solvente de lavagem
C – Concentração das impurezas na amostra (mg/L)
Cb – Branco do solvente de lavagem.
O princípio para este requerimento é que o produto a ser fabricado possa ser contaminado não mais que em uma proporção (normalmente 1/1000) da Dose Terapêutica Diária – DTD da substância contaminante que está sendo investigada na validação de limpeza. Esse método somente é aplicado quando a dose diária terapêutica é conhecida. É geralmente usado para mudanças entre processos de insumos farmacêuticos ativos e não para as demais substâncias (reagentes, solventes, intermediários etc.).
Na prática, não é um cálculo utilizado, pois leva em consideração poucos fatores.
MACO
Equação 1- MACO baseado em dose diária terapêutica
Procedimento:
Estabelece-se a quantidade aceitável de contaminante a ser transferida para o próximo produto – MACO (Maximum Allowable Carryover), utilizando-se a Equação 1:
Onde:
MACO – Maximum Allowable Carryover: Quantidade transferida aceitável do produto contaminante para o próximo produto.
DTDanterior – Dose terapêutica diária padrão do produto contaminante (anterior).
DTDseguinte – Dose terapêutica diária padrão do produto que sofre a contaminação (seguinte).
TML – Tamanho mínimo de lote do produto que sofre a contaminação (seguinte).
FS – Fator de segurança (normalmente utiliza-se o valor 1000).
Em lugar de se calcular cada mudança de situação para cada produto, um cenário de pior caso pode ser utilizado. Dessa forma, utiliza-se para o cálculo, o insumo farmacêutico ativo mais crítico (menor dose terapêutica) como contaminante em um insumo com a menor razão de tamanho de lote por dose terapêutica. Isso pode ser feito se for possível utilizar o mesmo valor de fator de segurança para todos os produtos (ou pode-se utilizar a menor razão TML/(DTDxFS).
Equação 2 – MACO baseado em NOEL (dados toxicológicos)
Com o resultado calcula-se o MACO de acordo com a Equação 3:
Equação 3 – MACO baseado em dados toxicológicos
Onde:
NOEL – Nível de efeito adverso não observado.
LD50 – Dose letal suficiente para matar 50% de determinada população em g/Kg
70 Kg – peso médio de um adulto
2000 – constante empírica, equivalente a 2000 mg/kg de peso corpóreo, recomendada pela Organização Mundial da Saúde – OMS
DTDseguinte – Maior valor de dose terapêutica diária para o produto que sofre a contaminação
TML – Tamanho mínimo de lote do produto que sofre a contaminação (seguinte)
FS – Fator de segurança
Guias da Garantia da Qualidade – ANVISA
No L3 do cálculo de LeBlanc/ANVISA o volume de amostragem do solvente contido no frasco para o swab é substituído pelo volume da rinsagem (divisor):
No entanto, na prática, é impossível amostrar o volume todo de rinsagem do último enxágue.
Outra questão neste caso é que a área de 25cm2 é substituída pela área do equipamento compartilhada com o produto (área de contato).
Desta forma temos:
O L1 e L2 permanecem inalterados.
Le Blanc
Racional segundo maximum allowable carryover
Onde:
A = mínima dose do ativo do produto mais crítico
B = máxima dose do produto subsequente
C = menor tamanho de lote do produto subsequente
D = total da área compartilhada entre os dois produtos
E = área de superfície do equipamento amostrada
F = volume da amostra de rinsagem
0,001 – Fator de segurança via oral
A única questão crítica para este cálculo é encontrar valores para E e F. Caso a amostragem do enxágue seja feita de forma separada (após o processo final de enxágue), então os valores para E e F são diretos (E é a área superficial “enxaguada” e F é o volume do enxágue a ser amostrado).
Importante notar que que isso se aplica caso a amostragem por rinsagem seja separado do enxágue por CIP ou um enxágue do tipo “despeje e preencha” (também chamado de “imersão agitada”). Caso uma amostra de validação de limpeza seja retirada do processo final do enxágue em um “despeje e preencha”, então os valores de E e F são também simples: E é a área de superfície e F é o volume do processo final de enxágue.
Mas como deve ser determinado o valor para F?
Segundo Le Blanc, há pelo menos duas possibilidades:
- Utilizar o valor real do processo final de enxágue (volume). Isto pode ser apropriado se houver liberação da água de forma padronizada e pré-definida de modo que cubra toda a superfície interna do equipamento dentro de um volume pré-estabelecido em CIP;
Nota: o equipamento amostrado deve incluir o recipiente de processo e a tubulação.
- Utilizar algum volume que corresponda, em termos de porcentagem, ao volume total do equipamento. Um valor normalmente utilizado é de 5-10% do volume do equipamento para aplicações CIP. Caso esta opção seja selecionada, é importante lembrar que este valor de 5-10% aplica-se ao equipamento limpo por CIP por meio de dispositivos de pulverização (spray ball). Caso a tubulação associada estiver incluída no equipamento amostrado, certifique-se de que volume que representa o volume total do enxágue final leve em consideração a tubulação do processo. Esse valor adicional pode ser igual ao volume real da própria tubulação.
Cálculo para swab
É o cálculo mais amplamente utilizado.
Erroneamente, é utilizado também para os limites das amostragens por rinsagem.
Há aqui duas variantes: ANVISA e LeBlanc
Le Blanc
É mundialmente utilizado e foi criado por Destin Leblanc.
Possui como princípio:
- Qualquer princípio ativo pode estar presente no produto subsequente em um nível máximo de 10 ppm.
- Qualquer princípio ativo pode ter no máximo de 1/1000 ppm da dose mínima diária dentro da dose máxima diária do produto subsequente.
Cálculo:
[quote_center]Nota: no L2 deve ser utilizado O MENOR VALOR entre o obtido no cálculo L1, ou NOEL/DDA e 10 ppm.[/quote_center]
Importante:
- A menor dose diária é expressa em µg e não em mg – e trata-se do ativo mais crítico
- O tamanho do lote é em Kg ou L
- O volume é a quantidade de solvente de extração contida no frasco de amostra. Este valor é padronizado/obtido por meio da validação analítica.
- A área da rota é a área total da rota produtiva do produto mais crítico em cm2 ,incluindo os utensílios de pesagem e manipulação.
- A área de amostragem é de 25 cm2. Empresas utilizam de forma errada a área de 100cm2, pois isso aumenta em 4 x o limite. Esta situação é permitida apenas para limites muito baixo, abaixo até do LQ e LD do método. Mesmo assim deve ser tecnicamente justificado em protocolo e em relatório.
Algumas empresas utilizam apenas a área da superfície interna do equipamento em estudo para frente. Mas está errado.
Ex de rota de líquidos:
Equipamento em estudo: Envasadora – considerar a soma da área dos utensílios de pesagem, utensílios de manipulação, reator, bomba de transferência e ou tubulação, tanque pulmão e envasadora, mesmo que seja o último equipamento da rota produtiva.
- A dose máxima do produto subsequente é a quantidade administrada total por dia do produto, e não do ativo.
Entenda melhor:
Ex: Ranitidina xarope 150 mg/5 ml como produto subsequente (B)
Posologia (bula) – maior dose terapêutica diária: Úlcera em adultos: tomar 3x ao dia
Neste caso seriam 3 doses de 150 mg/5 ml. Para o cálculo considere como dose máxima do produto 15ml (5ml x 3 vezes ao dia).
Quem considera 450mg está errado, pois está pensando no ativo e não no produto como um todo.
Já no caso de um produto cosmético , como por exemplo um sabonete ou shampoo, considere como a máxima dose diária o frasco inteiro do produto.
Isso não pode ser aplicado para medicamento (utilizar o volume do frasco inteiro), exceto em raros casos como os soros nasais (cloreto de sódio a 0,9%). Para medicamentos deve ser respeitada a posologia máxima para um adulto por dia descrito em bula.
Anvisa
Importante:
- A menor dose diária é expressa em mg.
- Apenas a etapa A do cálculo multiplica por 1000.
- O tamanho do lote é em g e não em Kg como no LeBlanc.
- No final o resultado é o mesmo, tanto por Leblanc quanto pelo cálculo da ANVISA.
Cálculo para Limite Microbiológico
Pouco utilizado, mas existe e pode ser adotado:
Onde:
LM – Limite Microbiológico
EP – Especificação do produto em UFC/g
TL – Tamanho de lote do produto B (g ou mL)
FS – Fator de segurança
ASE – Área da superfície dos equipamentos em comum entre A e B (cm²)
Consultoria especializada em Validação de Limpeza
Caso necessite de suporte técnico para elaboração dos documentos e cálculos da validação de limpeza, entre em contato:
Consultoria Farmacêuticas
Fernanda de Oliveira Bidóia
Diretora Técnica
Telefones:
Comercial + 55 11 3392 2424
Celular: + 55 11 992961326
End: Av. Marquês de São Vicente, 446 cjs 917A e B
São Paulo – SP
http://consultoriafarmaceuticas.com.br/
Referências
- Microbial Limits and Bioburden Test, Lucia Clontz
- D. A. LeBlanc, “Establishing Scientically Justified Acceptance Criteria for Cleaning Validation of Finished Drug Products”, Pharm. Technol. (Oct. 1998).
- D.A. LeBlanc, “Rinse Sampling for Cleaning Validation Studies”, Pharm. 22 (5), 66-74 (1998).
- D.A. LeBlanc, memos – 2000 to 2017
- FDA, “Guide to Inspections of Validation of Cleaning Processes”
- PDA, Cleaning Validation
- ANVISA: Validação de Limpeza para Farmoquímicos
- ANVISA: GUIAS RELACIONADOS À GARANTIA DE QUALIDADE – 2006
- FDA: Guide to inspections of topical drug products
- FDA – Pharmacology and Toxicology – Guidance for Industry Estimating the Maximum Safe Starting Dose in Initial Clinical Trials for Therapeutics in Adult Healthy Volunteers –2005
- WHO – World Health Organization – Training workshop on regulatory requirements for registration of Artemisinin based combined medicines and assessment.
- ACTIVE PHARMACEUTICAL INGREDIENTS COMMITTEE (APIC) – GUIDANCE ON ASPECTS OF CLEANING VALIDATION IN ACTIVE PHARMACEUTICAL INGREDIENT PLANTS – May-2014
- Pharmaceutical cGMPs for the 21st Century – A Risk Based Approach
- United States Code of Federal regulations Part 211 – Current Good Manufacturing Praticies for Finished
- GUIDANCE ON ASPECTS OF CLEANING VALIDATION IN ACTIVE PHARMACEUTICAL INGREDIENT PLANTS – ISPE – The official magazine of ISPE – November/December 2011 – vol. nº 31 nº 6., Fe