Depois de mais de um ano aguardando uma decisão sobre o futuro do Sistema Nacional de Controle de Medicamentos, eis que finalmente o Presidente da República Michel Temer sanciona a Lei nº 13410/16 dando fim à angústia anteriormente gerada no mercado farmacêutico por conta da PL 276/15 do Senador Humberto Costa do PT.
A confusão toda teve início logo após o Projeto de Lei propor alteração do prazo para a implantação do sistema de Serialização e Rastreabilidade de toda a cadeia de medicamentos, até então regulamentada por meio da RDC 54/13 da ANVISA, no qual o prazo final da implantação que era até Dezembro de 2016 e que poderia ser prorrogado por cerca de 16 anos, conforme previsto na PL.
Caso a proposta fosse aprovada, traria sensível atraso para a saúde brasileira, e também para o mercado nacional, se comparando o Brasil com outros países do mundo que já iniciaram a implantação do sistema.
Isso sem falar no prejuízo financeiro para as empresas fabricantes de medicamentos que já haviam investido em equipamentos e softwares para adequação da Norma.
Sensatez na aprovação da Lei 13.410 de 2016
O presidente, entendendo a necessidade de adequação do mercado, estabeleceu prazos mais coerentes para a implantação do Sistema Nacional de Controle de Medicamento.
A partir da data da publicação desta Lei (28/12/2016), a cadeia de medicamentos (fabricantes, distribuidores, estabelecimentos de saúde e comércio varejista) tem o [quote_center]
prazo máximo de até 5 anos para a implantação total do Sistema.
[/quote_center]
Como era e como ficou
Resumo da Lei nº 13410/16
- A lei vale apenas para medicamentos humanos, tendo sido revogada a proposta para a inclusão de medicamentos veterinários e produtos odontológicos.
- A Anvisa tem o prazo de 4 meses para regulamentar as operações (necessidade de publicação de nova RDC)
- Os testes com 3 lotes em toda a cadeia de medicamentos devem ser feitos em até um ano após a regulamentação da ANVISA.
- Os fabricantes terão até 8 meses após a conclusão dos testes para enviar o relatório para validação dos resultados por parte da ANVISA
- Após o envio do relatório, as empresas terão mais 3 anos para a implantação completa do sistema.
ANVISA
Recentemente, a Agência Sanitária promoveu discussões a cerca do SNCM devido à grande incógnita sobre o assunto.
Agora, após a publicação da Lei, a Anvisa deverá se posicionar e provavelmente publicará nova RDC de acordo com os novos prazos previstos.
Vamos aguardar.
Leia a Lei nº 13410/16 na íntegra
Altera a Lei no 11.903, de 14 de janeiro de 2009, para dispor sobre o Sistema Nacional de Controle de Medicamentos. Ver tópico (2 documentos)Leia a Lei nº 13410/16 na íntegra
O PRESIDENTE DA REPÚBLICA Faço saber que o Congresso Nacional decreta e eu sanciono a seguinte Lei:
Art. 1o É criado o Sistema Nacional de Controle de Medicamentos, visando a controlar a produção, a distribuição, a comercialização, a dispensação e a prescrição médica, odontológica e, caso contenha medicamento de uso humano, veterinária, assim como os demais tipos de movimentação previstos pelos controles sanitários. (NR)
Art. 2o O órgão de vigilância sanitária federal competente determinará, em normativa própria, as categorias de medicamentos produzidos, distribuídos, comercializados, dispensados ou prescritos no território nacional sujeitos ao Sistema Nacional de Controle de Medicamentos.
Parágrafo único. (Revogado). (NR)
Art. 3o O controle será realizado por meio de sistema de identificação individualizado de medicamentos, com o emprego de tecnologias de captura, armazenamento e transmissão eletrônica de dados.
§ 1o As embalagens de todos os medicamentos registrados receberão identificação específica baseada em sistema de captura, armazenamento e transmissão eletrônica de dados, contendo minimamente as seguintes informações:
I – número de registro do medicamento no órgão de vigilância sanitária federal competente;
II – número de série único do medicamento;
III – número do lote ou da partida do medicamento;
IV – data de validade do medicamento;
V – (revogado);
VI – (revogado);
VII – (revogado);
VIII – (revogado).
§ 2o O órgão de vigilância sanitária federal competente e o detentor do registro do produto poderão incluir outras informações, além das apresentadas nos incisos I, II, III e IV do § 1o. (NR)
Art. 4o-A. O Sistema Nacional de Controle de Medicamentos deverá contar com banco de dados centralizado em instituição do governo federal, para armazenamento e consulta das movimentações dos medicamentos sob sua responsabilidade.
§ 1o Cada membro da cadeia de movimentação de medicamentos é responsável por transmitir ao banco de dados a que se refere o caput todos os registros a respeito da circulação dos medicamentos sob sua custódia.
§ 2o As informações deverão estar consolidadas em banco de dados que permita a consulta pelo órgão de vigilância sanitária federal competente, quando solicitado.
§ 3o Comete infração sanitária o estabelecimento que deixar de comunicar qualquer informação a respeito da movimentação de medicamento.
§ 4o O membro da cadeia de movimentação de medicamentos terá acesso, para consulta, apenas aos dados por ele inseridos no sistema e àqueles estritamente necessários à adição de novas informações sobre a movimentação dos medicamentos sob sua custódia.
§ 5o As informações constantes do banco de dados previsto no caput devem ser tratadas como informações confidenciais, não podendo ser divulgadas ou comercializadas.
Art. 5o O órgão de vigilância sanitária federal competente regulamentará os aspectos operacionais do Sistema Nacional de Controle de Medicamentos no prazo de quatro meses, prorrogável mediante justificativa.
I – (revogado);
II – (revogado);
III – (revogado).
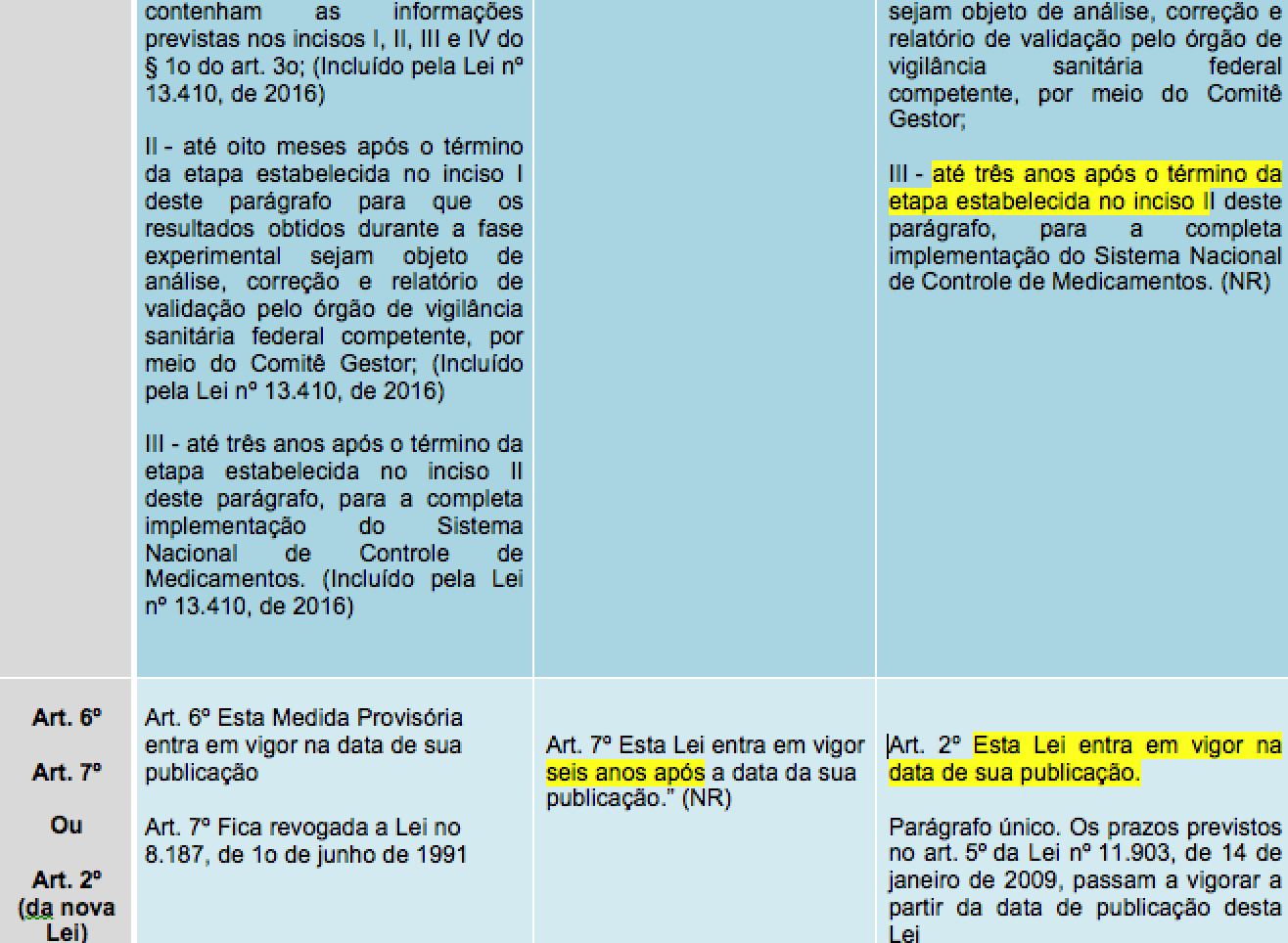
Parágrafo único. Depois de concluída a regulamentação de que trata o caput, as demais etapas de implantação do Sistema Nacional de Controle de Medicamentos obedecerão aos seguintes prazos:
I – até um ano, para que a indústria, os importadores e os representantes da distribuição e do varejo escolhidos pelo órgão de vigilância sanitária federal competente possam, em caráter experimental, receber e transmitir dados referentes a, no mínimo, três lotes de medicamentos que contenham as informações previstas nos incisos I, II, III e IV do § 1o do art. 3o;
II – até oito meses após o término da etapa estabelecida no inciso I deste parágrafo para que os resultados obtidos durante a fase experimental sejam objeto de análise, correção e relatório de validação pelo órgão de vigilância sanitária federal competente, por meio do Comitê Gestor;
III – até três anos após o término da etapa estabelecida no inciso II deste parágrafo, para a completa implementação do Sistema Nacional de Controle de Medicamentos. (NR)
Art. 2o Esta Lei entra em vigor na data de sua publicação. Ver tópico
Parágrafo único. Os prazos previstos no art. 5º da Lei nº 11.903, de 14 de janeiro de 2009, passam a vigorar a partir da data de publicação desta Lei. Ver tópico
Art. 3o Fica revogado o parágrafo único do art. 4o da Lei no 11.903, de 14 de janeiro de 2009. Ver tópico
Brasília, 28 de dezembro de 2016; 195o da Independência e 128o da República.
MICHEL TEMER
Ricardo José Magalhães Barros
Este texto não substitui o publicado no DOU de 29.12.2016
Fonte
Lei nº 13410/16: http://presrepublica.jusbrasil.com.br/legislacao/417320812/lei-13410-16
*








[…] era esperada desde a aprovação da Lei sobre o Sistema Nacional de Controle de Medicamentos: Lei nº 13410/16, pelo Presidente Temer ainda em Dezembro de 2016, no qual dava um prazo de 4 meses para a […]
[…] de como proceder durante mais de um ano. A rastreabilidade no Brasil ficou em stand-by até que a Lei nº 13410/16 foi sancionada em Dezembro de 2016 e posteriormente publicadas a RDC 157/17, e as Instruções […]