Para a implantação da sistemática de serialização e rastreabilidade segundo os requisitos da RDC nº 54/2013 há ainda muitas dúvidas e pontos que necessitam ser esclarecidos, além dos impactos na Indústria Farmacêutica.
Diante de tal cenário, o gestor de programa de Serialização Global da empresa Optel Vision, Jean-Pierre Allard “Jé – Pi”, trouxe esclarecimentos importantes sobre a implantação da norma e alguns estudos de caso. Tais esclarecimentos foram inicialmente apresentados em palestra que ocoreu há pouco tempo no ISPE Brasil e levou o seguinte tema:
[quote_center] Tendências e Experiências em Serialização e Rastreabilidade de Medicamentos[/quote_center]
Entre os principais tópicos abordados estão:
- Regulamentação mundial
- Soluções para frascos e cartuchos
- Agregação
- Embalagem manual
- Equipamentos de embalagem
- Arquitetura de TI
- Open-SCS – Padrão de comunicação de serialização
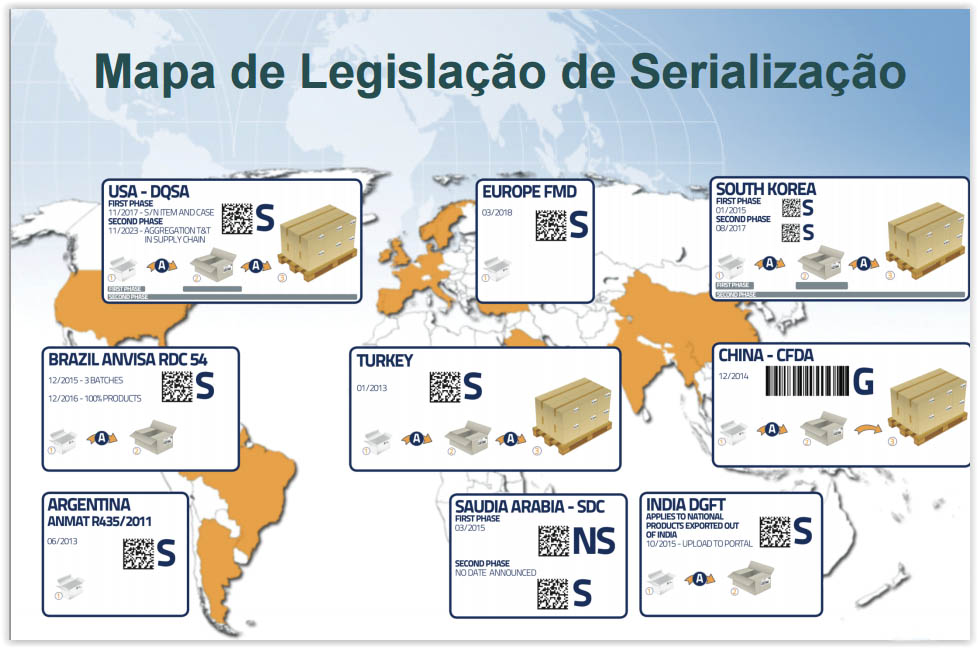
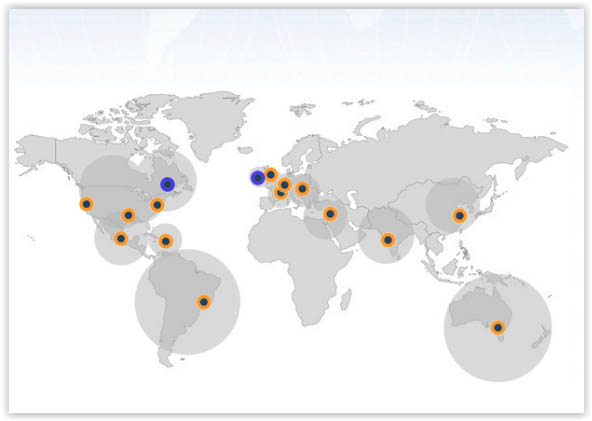
Regulamentos Mundiais
Em cada um dos países indicados na figura acima há uma legislação específica para a atividade de serialização e rastreabilidade de medicamentos. No Brasil, a ANVISA publicou a RDC nº 54 de Dezembro de 2013 para definir e padronizar as atividades relacionadas ao sistema.
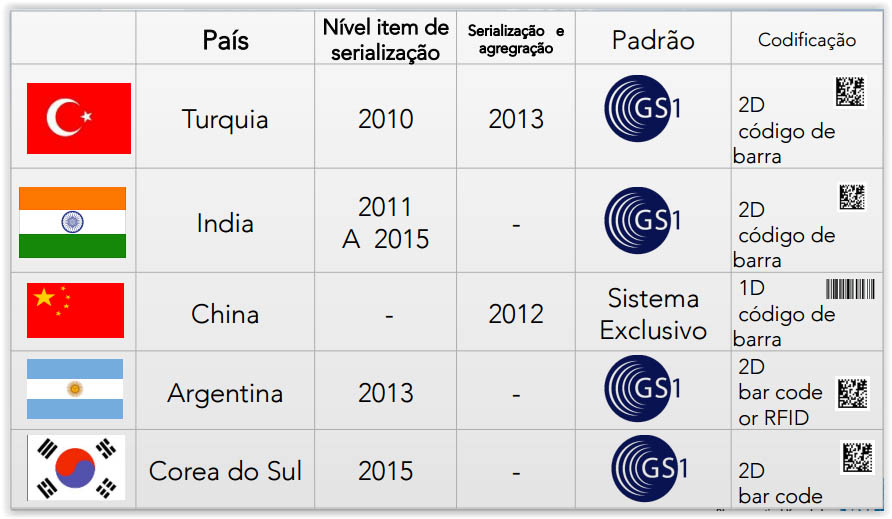
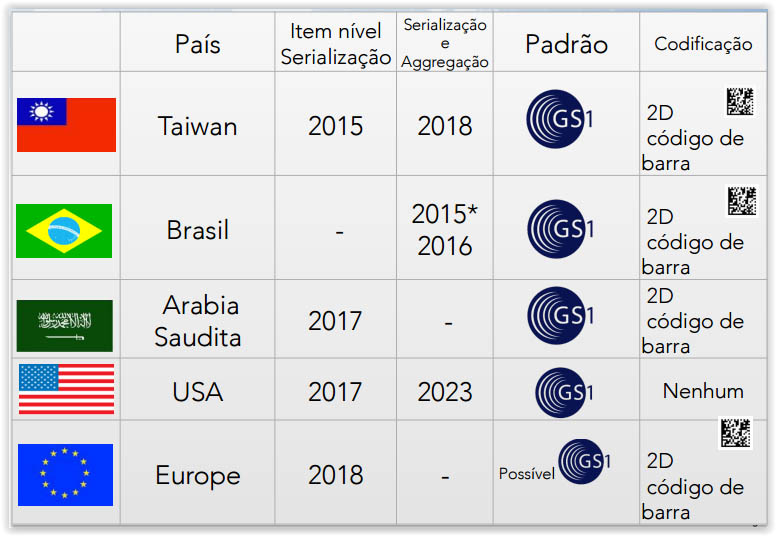
A nível mundial, temos a seguinte situação (apresentação feita de acordo com a data da implementação):
De uma foram geral, a atividade de serialização e rastreabilidade de medicamentos é relativamente nova nos países acima relacionados, porém promove grande um avanço na área da saúde mundial.
Informações requeridas no Brasil
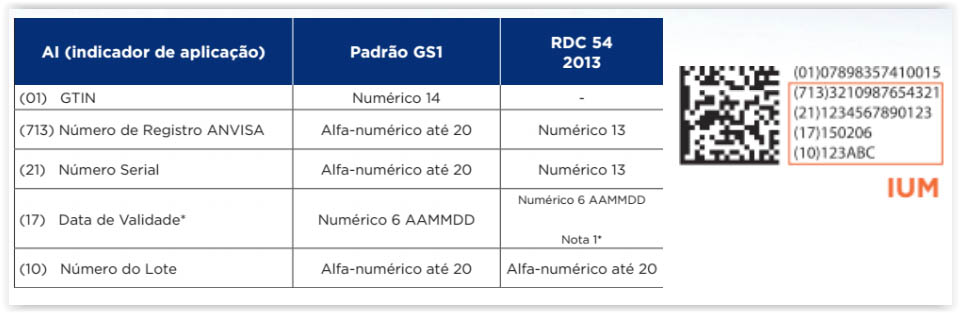
No caso específico do Brasil, a ANVISA definiu por meio da RDC nº 54/2013 o seguinte formato para a codificação das embalagens primárias e secundárias de medicamentos:
A identificação exclusiva de produtos é feita por atribuição de código Identificador Único de Medicamentos (IUM), correspondente à menor unidade de comercialização.
Sendo que:
- Identificador Único de Medicamento – IUM: uma série de caracteres numéricos, alfanuméricos, ou especiais, criada através de padrões de identificação e codificação, que permite a identificação exclusiva e inequívoca de cada unidade específica de medicamento comercializada no mercado.
- Número Serial: número individual, contido no IUM, não repetitivo, de 13 dígitos, correspondente a cada unidade de medicamento a ser comercializada no território brasileiro, codificado no código de barras bidimensional e inscrito de forma legível a olho humano na embalagem de comercialização, conforme disposto na norma.
Desta forma, o sistema deve gerar, posicionar e armazenar, os dados do IUM nas embalagens de todos os medicamentos comercializados e distribuídos no país.
A formação do IUM deve ser feita de acordo com a seguinte ordem:
- Número do registro do medicamento junto à Anvisa, contendo 13 (treze) dígitos
- Número serial (gerado por métodos randomizados e não determinados)
- Data de validade, no formato MM/AA
- Número do lote.
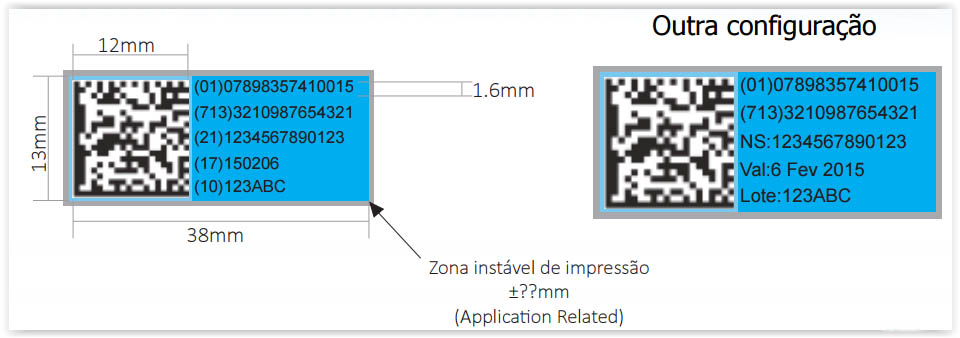
Na prática, a codificação no Brasil seria da seguinte maneira:
Configuração
• Datamatrix Modulo (0.5mm)
• Fonte (1.6mm)
Tamanho recomendado – perguntar para o jp
número em parenteses sao codigos tabela acima
Isso porque é obrigatória identificação para rastreamento desde da fabricação do produto até a entrada no estabelecimento que realiza a dispensação.
Sendo assim, devem haver IUM nas seguintes embalagens:
- Embalagens secundárias de todos os medicamentos (embalagens múltiplas, embalagens secundárias para fracionados e embalagens hospitalares)
- Embalagens primárias: para os medicamentos que não possuem embalagem secundária
- Embalagens de transporte deverão conter um código identificador no qual estejam relacionados todos os IUM que compõem a embalagem.
Etiquetas de identificação para caixas de embarque e paletes no Brasil
As caixas de embarque, assim como o paletes contendo as caixas de embarque de um determinado produto, devem seguir um padrão:
DUAS OPÇÕES DE ETIQUETA
(00) caixa de embarque
(01) produto – identificacao GREGACAO PERGURTAR PAR O jp
Estudo de caso
Impacto na linha
Solução tecnologicatecnologico
Rastreabilidade e soluções para frascos – começa aqui!!!
Lembrando que até o final deste ano (2015) a ANVISA determinou que sejam realizados pelas empresas detentoras de registro de medicamento testes contendo os dados de rastreamento completo de 3 (três) lotes em toda cadeia produtiva até as unidades de dispensação.
E para melhor compreensão de como funcionará a sistemática para codificação/serialização, inspeção e agregação, a Optel Vision elaborou ilustrações e vídeos explicativos:
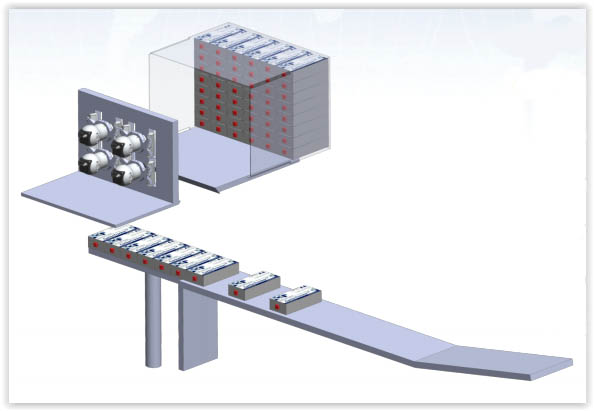
Estação de associação de frascos
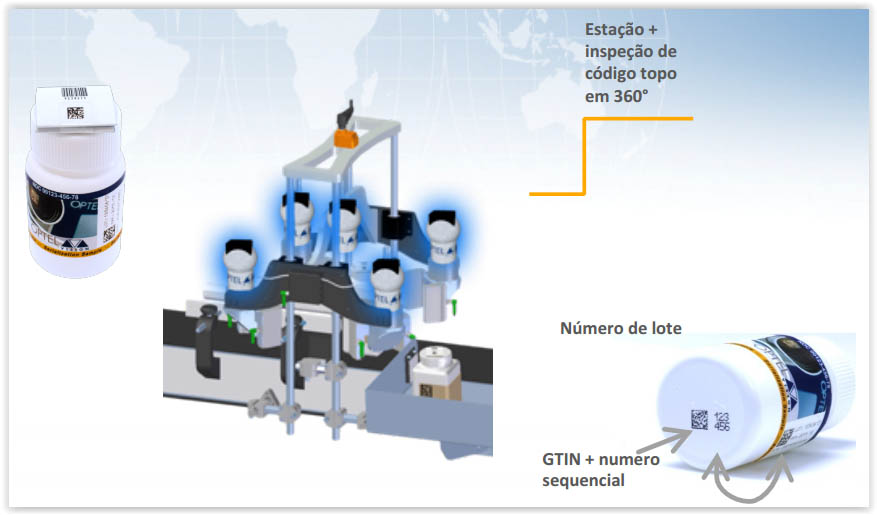
Exemplo de linha de embalagem serializada – Frascos
Exemplo de linha de embalagens de cartuchos
A Optel Vision traz ao mercado brasileiro diversos soluções tecnológicas para adequação das linhas de embalagem da indústria farmacêutica em atendimento aos requisitos da RDC nº 54/2013. Entre elas:
Serialização e Agregação de Cartuchos
Um excelente exemplo de solução tecnológica para linhas de embalagem, incluindo as manuais, é o equipamento Flying Carton Tracker™
Para mais informações sobre este equipamento leia o artigo:
Rastreabilidade e soluções práticas para cartuchos em esteira de transporte
?
Rastreabilidade e Soluções para embalagem semi-automática
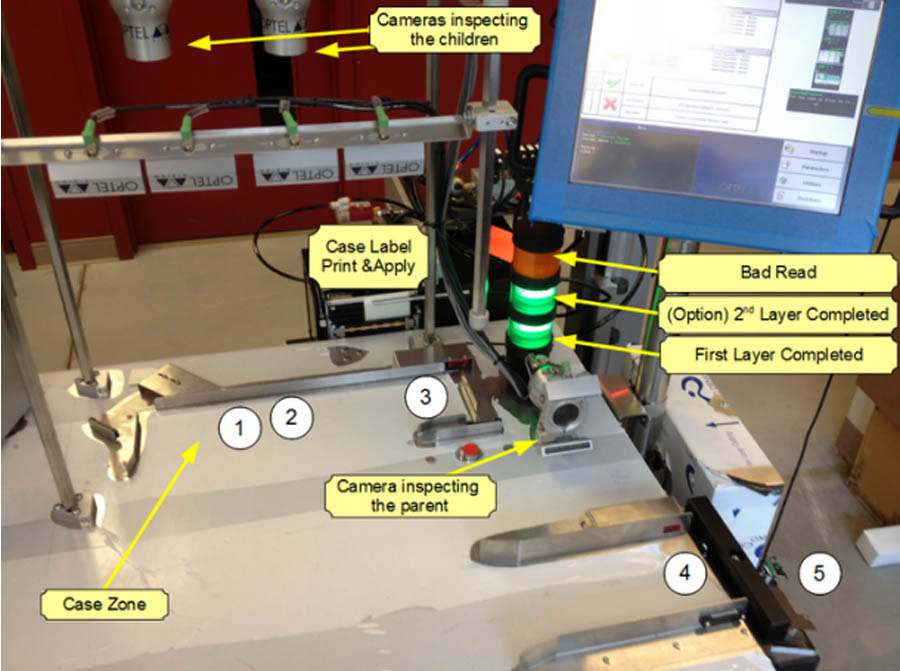
O equipamento PackStation™ oferece diversas configurações para otimizar o processo de embalagem, com ou sem agregação, garantindo a precisão da identificação de serialização, que respeita as exigências de autentificação e de rastreabilidade dos produtos da indústria farmacêutica.
A PackStation™ é uma estação de embalagem semi-automática operada por um ou vários operadores que permite a verificação dos dois lados do frasco individual, da embalagem cartonada e bundle num case único ou multi camadas. este equipamento identifica e verifica a etiqueta-pai sem alterar a ritmo do processamento da embalagem.
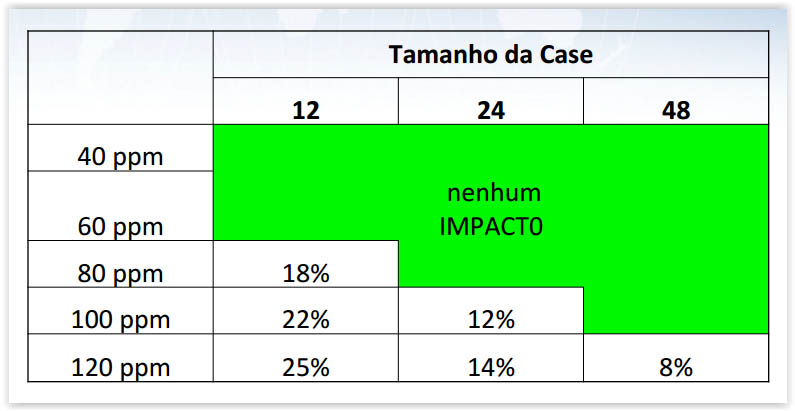
Impacto de operações de embalagem manual capturadas pelo sistema de serialização – 2 camadas
+2 sec : Scan de camada 1
+2 sec : Scan camada 2
-2 sec : Impressão automática
+1 sec : Inspeção da etiqueta da caixa
Extra 3 sec por caixa (para duas camadas)
18% de atraso no processo.
peças por milhão (pieces for milion)
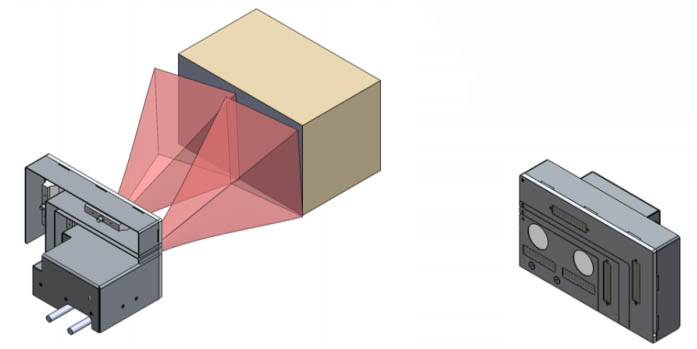
Rastreabilidade e soluções para equipamentos de embalagem
Conceito:
- Câmeras posicionadas numa esteira
- Aquisição após cada camada da esteira
- S/N deve ser no lado visível do cartucho
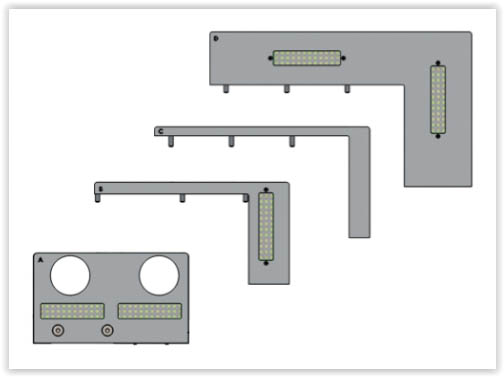
Solução para esteiras de embalagem – Embalagens de Múltiplos Formatos
- Visão permanente de câmeras por trás de placas menores
- Visão de câmeras voltadas para cada código de barra de embalagem maiores
câmaras
Solução para variados tamanhos de Case
Algumas placas adicionais vem com um alerta de luz que necessita ser conectado com um pequeno cabo anexado à câmera.
luz de led para iluminar e camera captar a imagem.
maior a iluminacao maior o campo de alcance da camera.
Estudo de caso – colocar pri
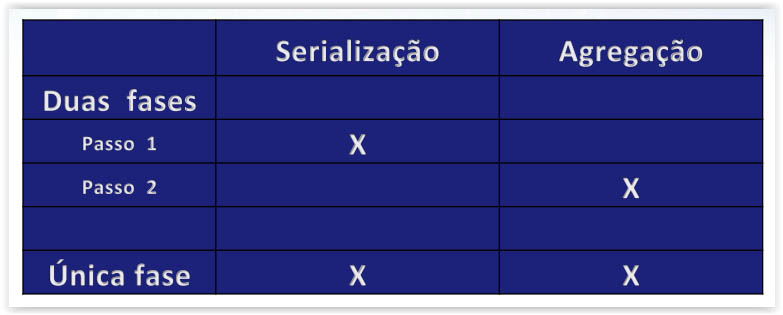
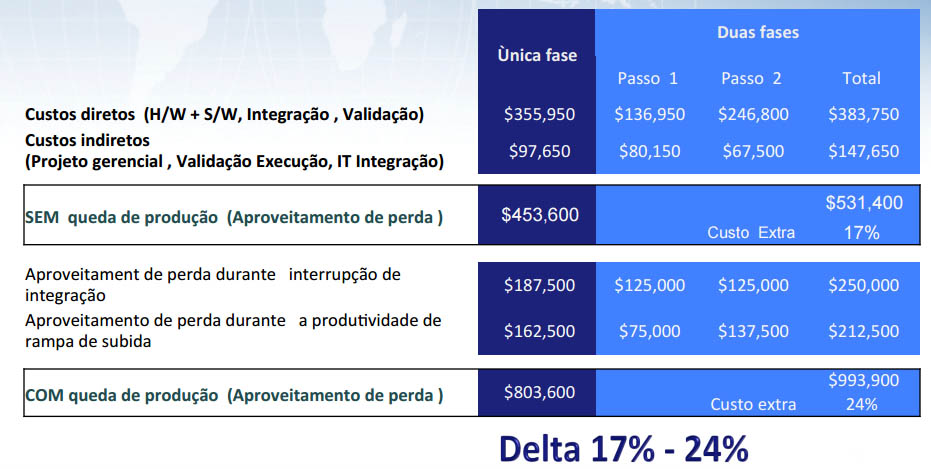
Agregação completa numa Fase única versus Duas fases
Configuração de Arquitetura TI – outro post
Segundo a norma da ANVISA, os sistemas informatizados utilizados para o fluxo e armazenamento das informações sanitárias no SNCM (Sistema Nacional de Controle de Medicamentos) devem assegurar o sigilo, a integridade, a interoperabilidade, a autenticidade e a disponibilidade dos dados e informações, de modo a viabilizar a execução das ações de fiscalização, controle e monitoramento.
Sendo assim, os sistemas informatizados devem ser estruturados e mantidos mediante mecanismo estabelecido assegurando as interfaces de acesso remoto para a Agência Nacional de Vigilância Sanitária, na qualidade de coordenador do SNCM.
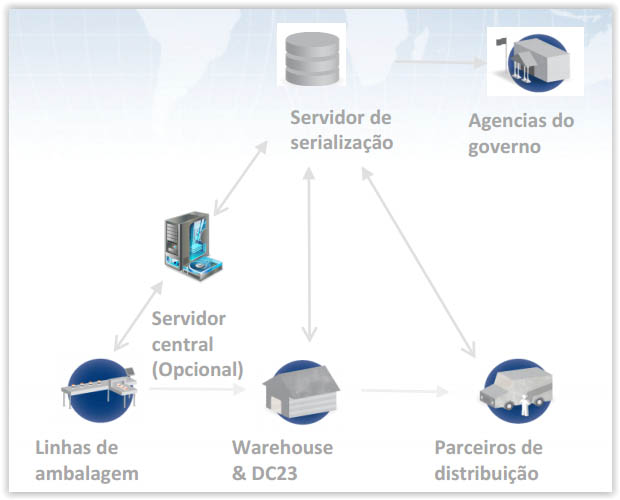
De acordo com a resolução a arquitetura de TI das empresas fabricantes devem ser estruturadas da seguinte maneira:
Características do servidor de Serialização
- Criação de número serial
- Banco de dados de Serialização
- Conexão com dados do Governo
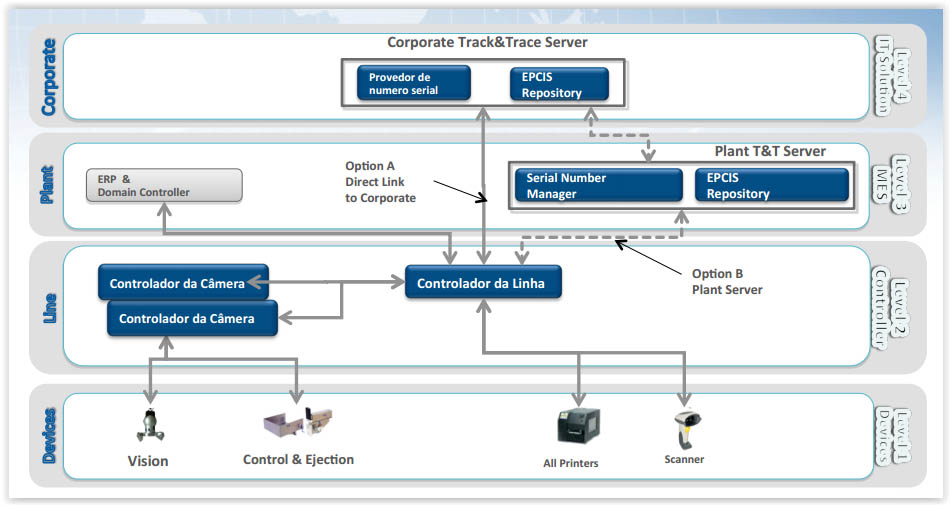
Exemplo de rastreabilidade – Arquitetura de TI
Estrutura de TI específica para o Brasil
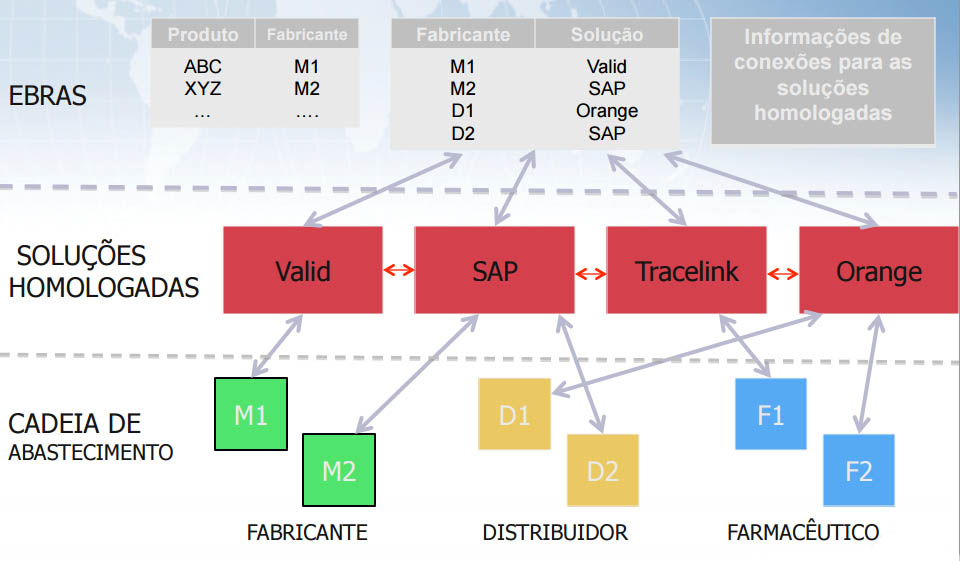
OPEN-SCS – Padrão de comunicação de serialização
Situação atual:
- Mais de 10 representantes de níveis de linhas de embalagens (L2)
- Mais de 20 sites e representantes de soluções de nível corporativo. (L3 e L4)
- Nenhum padrão de comunicação real . EPCIS não aborda todas as necessidades .
- Cada implementação de TI é personalizada.
Objetivo: Padronizar as seguintes comunicações
- Provisão de Números seriais
- Código de Produto Eletrônico (CPE ) Repositório (Transferência de e para)
- Lote & Master Data Repositório (Transferência de e para )
- Retorno de números seriais não usados.
- Importação completa de lotes
- Consulta de números seriais
Comitê Diretivo
Optel Vision, Abbou, NNE, SAP, Teva, Systech, Werum, Mylan, Famar, Antares
Sobre o palestrante Jean-Pierre Allard “Jé – Pi !”

Gestor de programa de Serialização Global
- Trabalha na Optel Vision desde 2008.
- Acompanha regulamentos e padrões de diversos países.
- Define Roadmap (roteiro) do produto.
- Revisa e aprova novas especificações de produtos.
Contato: jp.allard@optelvision.com
Sobre a Optel Vision
Fornecedor mundial no setor farmacêutico com 26 anos de expertise em soluções turnkey para software, ópticos, mecânicos e soluções TI
Mais de 400 funcionário e ainda em expansão
Maior gestor global de Soluções de Rastreabilidade
Sede corporativa Quebec, Canadá
Sede corporativa Limerick, Irlanda
Expansão mundial
• 3500 metros quadrados adicionais no prédio de da cidade de Quebec









Bom dia!
Fernanda, você tem mais material sobre o assunto?
Abs,