O tema Gerenciamento de Riscos não é novo, sendo este amplamente divulgado pelo ICH (Guia ICH Q9) desde de 2005 e pela ANVISA desde de 2013 para os mercados de cosméticos (RDC nº 48/2013) e de produtos para a saúde (RDC nº 16/2013), mas certamente para o setor farmacêutico é algo inédito que promete deixar os profissionais da área de garantia da qualidade de cabelos em pé!
A grande questão é que a área farmacêutica, infelizmente, ainda tem grande dificuldade em elaborar uma análise de risco com a utilização de ferramentas da qualidade adequadas, imagina agora ter que gerenciar uma atividade que será o coração das Boas Práticas de Fabricação?!?
Sem dúvida, será uma missão e tanto para esses profissionais.
Mas com a finalidade de ajudar àqueles que ainda não entenderam como será a implantação e gestão de tal atividade, o Portal Farmacêuticas trouxe algumas dicas fundamentais:
1. Não confunda Análise de Risco com Gerenciamento de Riscos
O primeiro passo para implementação da nova atividade, que por meio da CP nº 653/2019 visa a harmonização com o PIC/S, é entender que a atividade de elaboração de uma análise de risco, seja para a atividade de validação, ou mesmo para controle de mudanças, não pode ser classificada como sendo um GERENCIAMENTO DE RISCOS.
O gerenciamento de riscos vai muito além de uma AR, sendo este apenas o primeiro passo. É uma atividade ampla e multidisciplinar que tem como objetivo mitigar riscos, identificar possíveis causas e promover ações preventivas e controles para os desvios (falhas) não aconteçam, além de propor ações corretivas eficazes para que estes não sejam reincidentes.
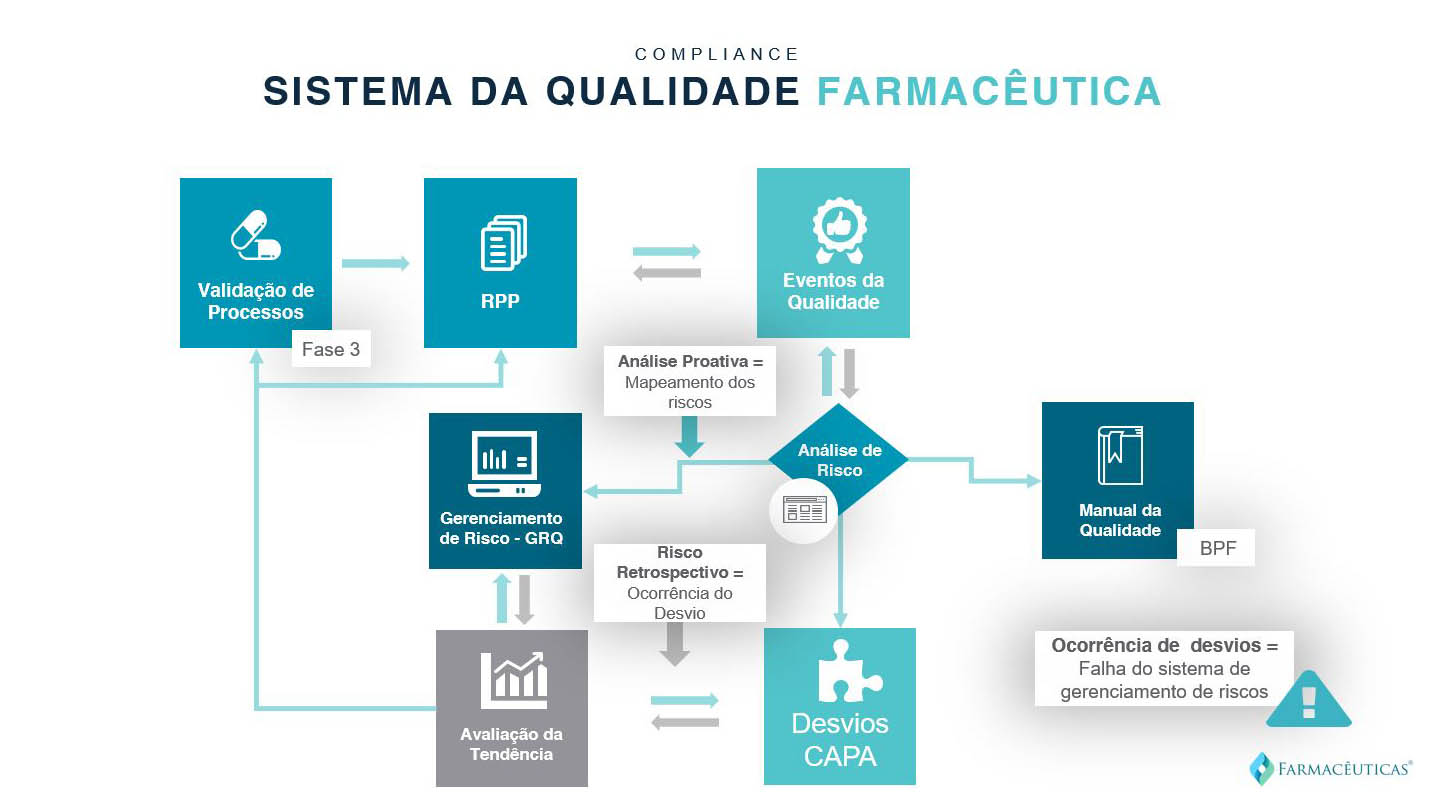
O Gerenciamento de Riscos deve fazer parte do manual da qualidade, e deve abranger todos os riscos e modo de falhas que possam acontecer na empresa (todos os departamentos com impacto BPx).
Não se trata da elaboração de uma planilha simplesmente, é um documento vivo, que deve ser periodicamente revisado segundo as ocorrências de falhas, avaliação de novos riscos, implementação de novos níveis de controle e, principalmente, com relação à avaliação da tendência [quote_center]Sim, estamos falando de estatística!!![/quote_center]
2. Mas o que é Gerenciamento de Riscos?
Os princípios da gestão de riscos devem ser utilizados nas diversas áreas e negócios das indústrias reguladas. Embora existam alguns poucos exemplos do uso de gerenciamento de risco de qualidade na indústria farmacêutica hoje, eles são limitados e não representam as contribuições totais que a gestão de riscos devem oferecer, ou seja, a aplicação de análises de risco em atividades como os estudos de validação, por exemplo, é apenas o começo.
Além disso, a importância do sistema da qualidade farmacêutica (sim, o nome agora é este para o antigo termo “Garantia da Qualidade”) tem sido reconhecido pela ANVISA e está se tornando evidente que o gerenciamento de riscos de qualidade é um componente valioso de um sistema de qualidade eficaz.
Mas em termos de significado, deve ser entendido que um risco é definido como a combinação da probabilidade de ocorrência de falhas (desvios da qualidade), dos níveis de detecção implementados pela empresa e a gravidade dessa falha (Grau do Risco – NPR). Neste sentido, qualquer desvio da qualidade que possa ter ocorrido na empresa (histórico de desvios) e possíveis falhas, mesmo que nunca tenham ocorrido, devem ser mitigados, ou seja, identificados e seus riscos calculados com base nos critérios anteriormente destacados.
A avaliação dos riscos deve ter base científica.
No entanto, é difícil obter uma compreensão compartilhada da aplicação do gerenciamento de riscos entre os diversos departamentos e atividades de uma empresa, pois cada parte interessada pode perceber diferentes falhas potenciais, colocar uma probabilidade diferente em cada falha ocorrida (desvio) e atribuir diferentes severidades a cada desvio. É por isso que se faz necessária a existência de um comitê multidisciplinar para avaliar todos os riscos.
Em relação aos produtos farmacêuticos (medicamentos), embora seja uma atividade obrigatória, e até mesmo regulatória, a finalidade do estudo deve assegurar a qualidade dos produtos fabricados de modo a proteger a saúde do paciente. [quote_center]Este é o maior, e principal, objetivo! [/quote_center]
3. Quais atividades e os assuntos devem ter seus riscos mitigados?
Todas as etapas da cadeia de produção do medicamento (do recebimento dos insumos, fabricação e análise do medicamento, até a sua expedição) devem ter seus riscos mitigados, uma vez que falhas podem acontecer de modo a prejudicar a qualidade do produto, e consequentemente, afetar a saúde do paciente/consumidor. [quote_center]A avaliação do risco deve ser global.[/quote_center]
O ideal é que a avaliação dos riscos seja feita de forma proativa, ou seja, sem que a falha (desvio) tenha ocorrido. Uma vez que há histórico (registro de ocorrência) do desvio, o gerenciamento passa a ser retroativo.
Exemplos de aplicação:
- Eventos da qualidade
- Desenvolvimento de produtos
- Utilidades e equipamentos
- Armazenamento de Materiais/insumos e produtos
- Produção
- Controle de Qualidade e estudos de estabilidade
- Rotulagem e embalagem
- Assuntos regulatórios
- Compartilhamento de áreas
- Inspeções sanitárias
4. Para que serve o gerenciamento de riscos?
A atividade de gerenciamento de riscos não é apenas um documento ou processo burocrático para atender uma exigência da ANVISA, vai muito além.
Para quem de fato ama qualidade é algo nos ajuda, e muito, na manutenção do SQF.
Sendo assim, alguns dos principais objetivos:
- Melhorar a tomada de decisões, caso surja um problema de qualidade
- Identificar possíveis falhas, antes que desvios aconteçam
- Avaliar a eficácia das ações – registro de treinamento e provinha já não podem mais serem considerados como comprovantes da eficácia de uma ação. Pelo amorrrr!
- Avaliar a tendência da ocorrência dos desvios
- Avaliar a tendência dos processos – verificação continuada do processo – Fase 3 da validação
- Fornecer às autoridades regulatórias informações sobre a segurança dos processos e da capacidade de uma empresa de lidar com os riscos potenciais e afetar beneficamente a extensão e o nível da supervisão regulatória direta
- Fornecer uma visão global do nível de qualidade e segurança da empresa
- Propor melhorias contínuas
- Diminuir o número de desvios da qualidade
- Aumento da produtividade
5. Quais as melhores ferramentas da qualidade para serem utilizadas na atividade de Gerenciamento de Riscos?
Existem algumas ferramentas disponíveis, alguns exemplos:
- Fluxogramas – não é o mais indicado
- Formulários de avaliação de riscos x espaços desenhos (ACQ x PCP – DOE) – serve apenas como draft inicial do gerenciamento de riscos – Fase 1
- Failure Mode Effects Analysis (FMEA) – é a melhor opção!!!
- Failure Mode, Effects and Criticality Analysis (FMECA) – é a melhor opção!!! Continuação da FMEA
- Fault Tree Analysis (FTA) – Deve fazer parte – ações corretivas
- Hazard Analysis and Critical Control Points (HACCP) – não é indicado para a indústria farmacêutica. Para indústria alimentícia tá ok…
- Hazard Operability Analysis (HAZOP) – não é indicado
- Preliminary Hazard Analysis (PHA) – não é indicado
- Ferramentas estatísticas – obrigatório!
6. E o GAMP5?
O GAMP5 é uma excelente ferramenta da qualidade para análise de risco, mas deve ser utilizada apenas para avaliação de possíveis falhas de sistemas computadorizados com impacto BPx por ser uma ferramenta qualitativa e não quantitativa.
Como temos que quantificar os riscos, em termos de gravidade, ocorrência, etc, a pontuação, ou seja, a avaliação quantitativa, é obrigatória e por este motivo o GAMP5 não é recomendado.
Lembrando que números obtidos devem ser avaliados estatisticamente – análise de tendência!!!
7. O que é quality by design?
Quality by Design é uma abordagem sistemática que se inicia com objetivos preestabelecidos e foca no conhecimento do produto e do processo e no controle do processo, embasada na ciência e no gerenciamento de risco da qualidade.
Antes de pensar em gerenciar os riscos a empresa precisa definir a sistemática relacionada ao Quality by Design, ou seja, deve planejar corretamente seus processos, definir parâmetros e especificações e mitigar possíveis riscos.
Nesse sentido, os primeiros passos são:
- Fase 1 da Validação de Processo e DOE
- Risk Management
- Estratégias de Controles
- Oportunidades de Melhoria
- Decisões
- Impactos Regulatórios
- Avaliação de tendência
- Fase 3 da validação de processo – verificação continuada
Referente à fase 1 da validação de processo (DOE = Design of Experiment):
- Definição do QTPP – Quality Target Product Profile – definição do uso e da finalidade do produto. Avaliar o conhecimento prévio para entender as variáveis e seu impacto
- Definição dos Atributos Críticos da Qualidade (ACQ) – determinação inicial
- Definição dos Parâmetros Críticos do Processo (PCP) – que impactam no ACQ
- Estabelecimento do espaço desenho teórico – matemático e documental
- Mitigação dos riscos iniciais – análise de risco
- Execução de testes
- Realização de análises
- Submissão regulatória
Iniciando um Processo de Gestão do Risco da Qualidade
O gerenciamento do risco da qualidade deve incluir processos sistemáticos projetados para coordenar, facilitar e melhorar a tomada de decisão baseada em ciência com relação ao risco. As possíveis etapas usadas para iniciar e planejar um processo de gerenciamento de riscos de qualidade podem incluir os seguintes passos:
• Mapeie as ocorrências de desvios e identifique riscos de falhas em potencial
• Reúna informações de base e / ou dados sobre as potenciais falhas e desvios registrados segundo o risco de impacto na saúde humana
• Determine um comitê multidisciplinar e faça uma previsão para o budget do projeto
• Especifique um cronograma com responsáveis, entregas e nível apropriado de tomada de decisão para o processo de gerenciamento de risco
Importante ressaltar que todos os possíveis riscos, principalmente os relacionados ao processo, devem ser mapeados e devidamente mitigados.
A estratégia, independente da ferramenta da qualidade (lembrando que devemos escolher o FMEA/FMECA), deve ser conforme o racional do diagrama de Ishikawa, levando em consideração os 6M:
- Mão-de-obra
- Meio ambiente
- Máquina
- Material
- Método
- Medida
Risk Management
- O que pode dar errado (causa)?
- Qual é a probabilidade de dar errado (ocorrência)?
- Quais os níveis de detecção em caso de desvio (falha)?
- Quais são as consequências (gravidade – criticidade do desvio)?
- Há impacto do ACQ?
- Quais são os controles?
- Existem ações para prevenir as falhas?
- Quais as decisões a serem tomadas em casos de desvio?
- Quais são os impactos para a saúde do paciente?
- Quais são os impactos regulatórios?
- Há perda da validação?
8. O que a Validação tem a ver com o Gerenciamento de Riscos?
Hoje em dia, na grande maioria das empresas, as atividades de validação de processos e tratamento de desvios (compliance) são distintas, mas com a publicação da nova RDC de BPF estas atividades serão complementares.
O gerenciamento de risco deve contemplar os processos, que por sua vez devem ser monitorados (verificação continuada – fase 3) para manter o status de validados dos produtos. A ocorrência de desvios em produtos, no qual a causa raiz está ligada ao processo, impacta diretamente nos estudos de validação, sendo necessária a abertura de controle de mudanças, análise de risco, retorno à fase 1, para possíveis ajustes de formulação, PCP e/ou ACQ. Algo nada simples…
Sendo assim, a GQ monitora a ocorrência de desvios enquanto a validação de processo verifica de forma contínua os processos por meio da análise de tendência do espaço desenho (ACQ x PCP).
E o RPP?
Este apenas reúne todas as informações para colocar no relatório periódico de produto.
Tudo está interligado!!!
10. Estatística e o Sistema da Qualidade Farmacêutica
A ocorrência dos desvios, não importa a origem (autoinspeções, reclamações técnicas, processos, validações, documentação, etc) deve ser monitorada por meio do gerenciamento de riscos. O monitoramento é importante e deve ser feito tanto a nível documental quanto por meio estatístico.
Nesse sentido, as ferramentas estatísticas mais utilizadas são:
- Capabilidade
- Cartas de controle
- Tendência
- Diagrama de Pareto
- Box Plot
- Entre outras
11. Documentos relacionados
Não basta “planilhar”, tem que formalizar.
Por este motivo, as planilhas, tabelas, etc, devem ser regidas por meio de sistema de gestão documental (código, versão, aprovação, etc), e relatórios para cada versão do documento devem ser emitidos contendo todos os detalhes e conclusões sobre gerenciamento de riscos realizado.
12. Etapas do gerenciamento de riscos
Depois do textão, chega o momento do breve resumo sobre as etapas do gerenciamento de riscos:
- Identificação dos riscos
- Análise dos riscos
- Avaliação dos riscos – criticidade
- Controle dos modos de falha
- Ações de prevenção e correção para diminuição das falhas
- Critérios de aceitação
- Comunicação
- Revisão
- Análise estatística
Curso de Gerenciamento de Riscos
Apesar das explicações dadas neste post é normal que o profissional da qualidade ainda tenha muitas dúvidas com relação à implantação da atividade de gerenciamento de riscos.
E para ajudar estes profissionais a Consultoria Farmacêuticas traz com exclusividade e inovação o curso de GERENCIAMENTO DE RISCOS SEGUNDO A RDC 301/2019 – ANVISA




















[…] O estabelecimento do valor de PDE, que é um limite baseado em saúde (health based limits – HBL) é o ponto de partida para traçar estratégias eficientes para prevenção e controle da contaminação cruzada, com base no risco real, auxiliando na estruturação dos Sistemas de Qualidade Farmacêutica e Gerenciamento de Risco. […]
Preciso fazer curso de Gerenciamento de risco e quero apagar a metade no pix. O site não tem ctto por celular. Preciso assistir nesse fds. Como faço ?