Apesar no guia do ICH Q3D GUIDELINE FOR ELEMENTAL IMPURITIES ter sido publicado em 2015, e ter prazo de implantação de 36 meses, poucas empresas no Brasil começaram a utilizar a pesquisa de impurezas elementares na rotina da indústria farmacêutica. Na verdade, o seu uso começou a ser aplicado somente após a vigência dos capítulos 232 e 233 da USP, agora em 2018.
Mesmo assim, a pesquisa de impurezas elementares está sendo parcialmente aplicada durante as análises de rotina. As demais aplicações do guia ainda não foram integralmente “processadas” pela indústria farmacêutica e é justamente neste aspecto que este post vem debater.
Então para começar, vamos entender melhor o que são as impurezas elementares:
Impurezas elementares
O primeiro passo é entender o que são as impurezas elementares, que nada mais são que os metais pesados e suas diversas fontes de contaminação. Isso porque os fabricantes de medicamentos devem garantir que possíveis elementos considerados como impurezas elementares (metais pesados) estejam presentes nos produtos fabricados dentro de limites previamente estabelecidos (PDE), além de manter sob controle as principais fontes de contaminação.
Quais são as principais impurezas elementares?
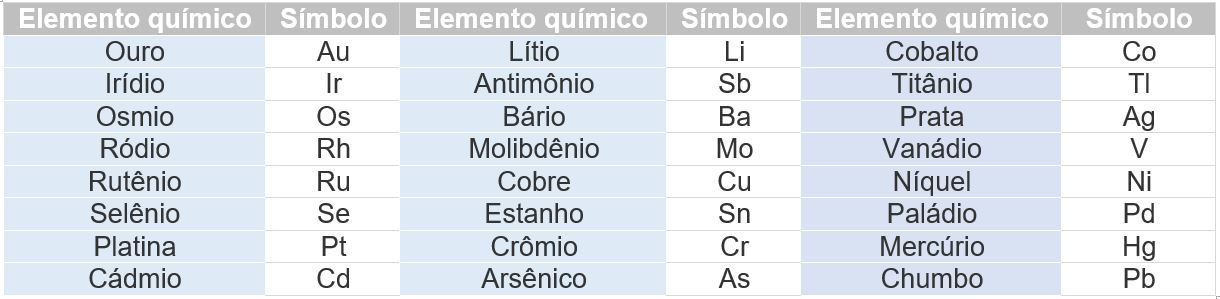
A relação dos elementos químicos que devem ser pesquisados estão descritos na tabela abaixo:
Importante ressaltar que a pesquisa é individual, para cada tipo elemento químico, e não mais em conjunto como anteriormente, onde era aplicado o teste geral para metais pesados.
Classificação da Impurezas Elementares
As impurezas elementares listadas anteriormente ainda são classificadas em 3 grupos de acordo com a sua toxicidade (PDE), probabilidade de uso no processo produtivo do medicamento e ainda pela quantidade presente nos materiais em contato com o produto (abundância do elemento):
- Classe 1: Elementos As, Cd, Hg, e Pb, que são conhecidos pela sua alta toxidade em humanos, e que não devem ser utilizados em medicamentos. Estes elementos devem ser pesquisados em todas as possíveis fontes de contaminação, a não ser que a necessidade não seja apontada na Análise de Risco.
- Classe 2: Elementos que geralmente podem ter ocorrência de presença nos medicamentos e que podem ser considerados como tóxicos ao paciente humano. Ela classe possui 2 subdivisões:
- Classe 2A: Co, Ni e V. Estes elementos possuem alta probabilidade de estarem presentes nos medicamentos humanos. Por este motivo, a análise de risco requer o cruzamento completo das principais fontes de contaminação, incluindo toda a rota produtiva do medicamento, excipientes, água e IFA.
- Classe 2B: Ag, Au, Ir, Os, Pd, Pt, Rh, Ru, Se e Ti. Estes elementos possuem baixa probabilidade de estarem presente no medicamento. Estes elementos podem ser excluídos da Análise de Risco, desde de que não sejam intencionalmente adicionados na fase de síntese das IFAs e excipientes, ou mesmo na formulação do medicamento.
- Classe 3: Ba, Cr, Cu, Li, Mo, Sb, e St. Estes elementos possuem baixa toxicidade quando administrados por via oral. Mesmo assim, devem ser considerados na Análise de Risco para administração por vias inalatórias e parenterais. Devem ser considerados por via oral apenas em casos de adição intencional na formulação.
- Outros elementos: Algumas impurezas elementares nas quais os PDEs não tenham sidos estabelecidos devido às baixas toxicidades conhecidas. São eles: Al, B, Ca, Fe, K, Mg, Mn, Na, W e Zn.
Nota: Importante ressaltar que apesar de terem baixa toxicidade, estes elementos podem comprometer funções importantes do organismos:
- Alumínio: funções renais
- Zinco e Manganês: funções hepáticas
Questões relacionadas à qualidade também devem ser consideradas, como é o caso do Tungstênio presente nas proteínas de uso terapêutico.
Aplicação
A pesquisa de impurezas elementares deve ser realizada por empresas farmacêuticas fabricantes dos seguintes tipos de medicamentos (comercializados e novos):
- Sintéticos
- Medicamentos que contém proteínas e polipeptídeos (origens recombinantes e não recombinantes) e seus derivados
- Medicamentos que contém polipeptídeos, polinucleotídeos e oligossacarídeos sintéticos
Já a pesquisa não se aplica aos seguintes tipos de medicamentos e terapias:
- Fitoterápicos
- Radiofármacos
- Vacinas
- Células metabólicas
- Produtos provenientes de DNA,
- Extratos alérgicos
- Células sanguíneas
- Componentes do sangue, incluindo o plasma e se seus derivados
- Soluções para diálise não utilizadas na circulação sistêmica
- Elementos intencionalmente incluídos no medicamento para fins terapêuticos (polivitamínicos contendo minerais)
- Produtos para terapia genética
- Terapia celular
- Tecidos utilizados em terapias
- Medicamentos em fase de pesquisa clínica (estágio de desenvolvimento)
Entendendo o PDE
O PDE (Permitted Daily Exposure), ou simplesmente exposição diária permitida, representa uma dose específica de uma substância que improvavelmente causaria um evento adverso em um indivíduo quando exposto à uma dose abaixo da especificada diariamente por toda a sua vida.
Complicado, né?!?
Vou esclarecer melhor com um exemplo que sempre dou em aula (curso de validação de limpeza avançado):
Pensando em um medicamento antineoplásico (oncológico), o PDE seria o limite, ou a quantidade mínima por dia, de um ativo deste medicamento no qual um indivíduo saudável poderia ficar exposto sem causar um câncer (evento adverso), decorrente desta única exposição, em qualquer momento de sua vida.
[quote_center] Isso porque a exposição de um indivíduo saudável a um medicamento oncológico pode gerar um câncer em algum momento de sua vida, por isso, a importância do PDE para definição do limite de exposição à substância.[/quote_center]
Agora, com relação aos limites (PDE) de cada impureza elementar, o guia traz no anexo 2 o cálculo do valor individual, em µg/dia (exposição diária) e µg/g (ppm) de acordo com cada via de administração do medicamento (oral, inalatória e parenteral).
Importante ressaltar que o limite para o cádmio foi revisto porque o cálculo estava errado. Por conta disso, o ICH lançou agora em 2018 o rascunho do novo guia:
- ICH Q3D(R1) – GUIDELINE FOR ELEMENTAL IMPURITIES – Cadmium Inhalation PDE – draft – 2018: Faça o download gratuíto clicando no link a seguir: Q3D-R1EWG_Document_CadmiumPDEGuideline_Step2_2018_0518
E para saber mais sobre o cálculo de PDE, em breve disponibilizaremos um artigo exclusivo.
Aguardem!
Fontes de contaminação
A pesquisa de impureza elementares não deve ser feita apenas para as IFAs (ingredientes farmacologicamente ativos) ou excipientes, ela deve abranger também às seguintes possíveis fontes de contaminação:
- IFA – decorrente do processo de síntese ou adição de solventes inorgânicos
- Excipientes
- Água
- Equipamentos
- Container de armazenamento de medicamentos
Cabe à indústria farmacêutica garantir (controlar) que o limite de cada elemento químico esteja dentro do especificado em qualquer uma destas fontes de contaminação do medicamento.
Finalidade das avaliações
A pesquisa de impurezas elementares tem como finalidade:
- Avaliação dos dados de toxicidade dos potenciais metais pesados (impurezas elementares);
- Estabelecer o limite de exposição diária permitida (PDE) de cada elemento;
- Identificar as fontes potenciais de contaminação;
- Controlar o risco da presença de metais pesados no medicamentos.
Informações que devem constar na análise de risco
Para identificar a necessidade de realização dos testes de impurezas elementares, os profissionais designados da indústria farmacêutica devem elaborar uma análise de risco contendo as seguintes informações:
- Identificação das possíveis impurezas elementares presentes no medicamento;
- Classe das impurezas elementares;
- Identificação das fontes de contaminação das possíveis impurezas elementares: equipamento ou recipiente, água, formulação, etc;
- Material de construção dos equipamentos e containers de armazenamento (ex: inox 316L, 304, etc);
- Forma farmacêutica do produto em contato;
- Variabilidade do método analítico;
- Área de superfície do equipamento em contato com o produto;
- Duração do tempo de estocagem (holding time);
- Via de adminstração do medicamento.
A conclusão da Análise de Risco deve conter ainda:
- Referências bibliográficas;
- Referências aos estudos de validação e qualificação;
- Dados dos materiais construtivos dos equipamentos (fabricante do equipamento);
- Resultado de análise das IFAs e excipientes;
- Eficiência na remoção de impurezas elementares durante o processo de limpeza (validação de limpeza);
- Fonte natural das impurezas elementares;
- Especificações dos limites de impurezas elementares (para cada fonte de contaminação em específico);
- Composição do medicamento;
- Demais pesquisas baseadas na formulação e no processo.
O Guia do ICH Q3D GUIDELINE FOR ELEMENTAL IMPURITIES traz um modelo de análise de risco, baseado no Guia ICH Q9, para ser utilizado pelos profissionais.
Fica a dica.
Formulação em contato com a superfície
Deve ser feita uma avaliação completa de cada medicamento incluindo:
- pH
- Produto hidoróbico ou hidrofílico
- Íons
- Área de superfície interna dos equipamentos e containers em contato com o produto
- Temperatura de processo (produtos de cadeia fria x tºC ambiente x processo com etapa de aquecimento)
- Etapa de esterilização terminal
- Processo de embalagem
- Componentes da esterilização
- Tempo de duração da estocagem (estudo de holding time)
- Via de administração do medicamento
Impurezas elementares na validação de limpeza
A validação de limpeza já era complicada por si só, e agora, além das pesquisas do ativo, produto de degradação, detergente e micro, também devem ser feitas as pesquisas de impurezas elementares.
Na verdade, esta pesquisa acaba sendo um mix entre a validação de limpeza e a qualificação de instalação, visto que a não liberação desses íons metálicos nos equipamentos deveria ser garantida pela passivação e pelo eletropolimento. No entanto, esta avaliação na qualificação de instalação é superficial, e na prática não existe um prazo de validade para que os equipamentos sejam submetidos à estes processos novamente. Vai muito do “feeling” das equipes de produção, manutenção e qualificação.
Sendo assim, este estudo, a partir de agora, deve contemplar a pesquisa de impureza elementares.
Ah, importante:
[quote_center]Para a validação de limpeza o método de pesquisa de impurezas elementares (amostragem, extração, recuperação e análise) deve estar validado conforme a RDC n° 166/2017.[/quote_center]
Referências e download gratuíto dos Guidelines
- ICH Q3D(R1) – GUIDELINE FOR ELEMENTAL IMPURITIES – Cadmium Inhalation PDE – draft – 2018: Q3D-R1EWG_Document_CadmiumPDEGuideline_Step2_2018_0518
- ICH Q9
- ICH Q3D – GUIDELINE FOR ELEMENTAL IMPURITIES – 2015
- EMA- ICH guideline Q3D on elemental impurities – 2011: EMA-ICH guideline Q3D on elemental impurities
- USP 41
- RDC n° 166/2017