Entendendo o controle de mudanças
Assim como as empresas devem documentar todo o histórico do processo de um produto, suas especificações e suas diversas atividades descritas em procedimentos operacionais padrão, as respectivas alterações também devem ser registradas e gerenciadas, pois mudanças podem gerar impactos em processo, estudos de validação e em sistemáticas relacionadas ao gerenciamento da qualidade.
Além do impacto no sistema de gestão da qualidade, mudanças também podem impactar em requisitos Legais e até mesmo comerciais. Desta forma, as empresas devem definir, avaliar, ver a possibilidade de abrangência, registrar, aprovar e gerenciar todas as mudanças que ocorrem dentro da área industrial.
Programas de controle de mudanças são considerados elementos essenciais dos sistemas de gestão da qualidade.
Inicialmente, somente as indústrias farmacêuticas utilizavam este recurso de controle, porém, com a publicação de normas de BPF (RDCs) da ANVISA as indústrias de cosméticos, saneantes, de excipientes farmacêuticos, veterinária e de fitoterápicos também devem adotar este sistema de controle de mudanças (Change Control).
Objetivos e aplicação do controle de mudanças
O controle de mudanças, deve ser aplicado para todos os tipos de alterações que podem influenciar o processo ou a qualidade do produto.
Deve ser utilizado nos seguintes casos:
- Alteração de formulação;
- Mudança, alteração, inclusão ou reforma de um equipamento;
- Alteração de uma utilidade;
- Alteração de parâmetros e etapas de processo
- Alteração de especificação (matéria-prima, material de embalagem, semi-acabado)
- Alteração de parâmetros de limpeza
- Alteração de agentes de limpeza
- Mudança no fluxo produtivo
- Alteração de um projeto
- Alteração de um desenho/planta
- Reformas na unidade industrial
Etapas do controle de mudanças
São muitas as etapas que envolvem o gerenciamento do controle de mudanças. São elas:
- Avaliação da necessidade da mudança
- Solicitação de mudança;
- Registro das informações referentes ao controle de mudanças
- Revisão do impacto dos custos, prazos e benefícios gerados pela mudança;
- Avaliação do impacto
- Avaliação do risco
- Aprovação de todos os responsáveis pelos setores envolvidos;
- Reunião com os setores envolvidos na mudança:
- Replanejamento contemplando a mudança;
- Ações propostas
- Cronograma referente à implantação da mudança
- Relação de documentos a serem elaborados e/ou revisados;
- Execução e controle da mudança;
- Encerramento da entrega ou resultado contemplando a mudança.
- Monitoramento da mudança
A equipe de garantia da qualidade, compliance, ou de sistemas de gestão da qualidade devem ser constituída de profissionais qualificados capazes de avaliar e gerenciar todos os possíveis impactos que podem ser gerados através de uma alteração.
A equipe de qualidade deve ser responsável pelo gerenciamento de todo o processo que envolve o controle de mudanças.
O ideal é que haja um comitê formado por representantes de cada departamento da empresa que sejam designados para registrar, aprovar e acompanhar os resultados, execuções das ações e prazos previstos em cada registro de controle de mudanças.
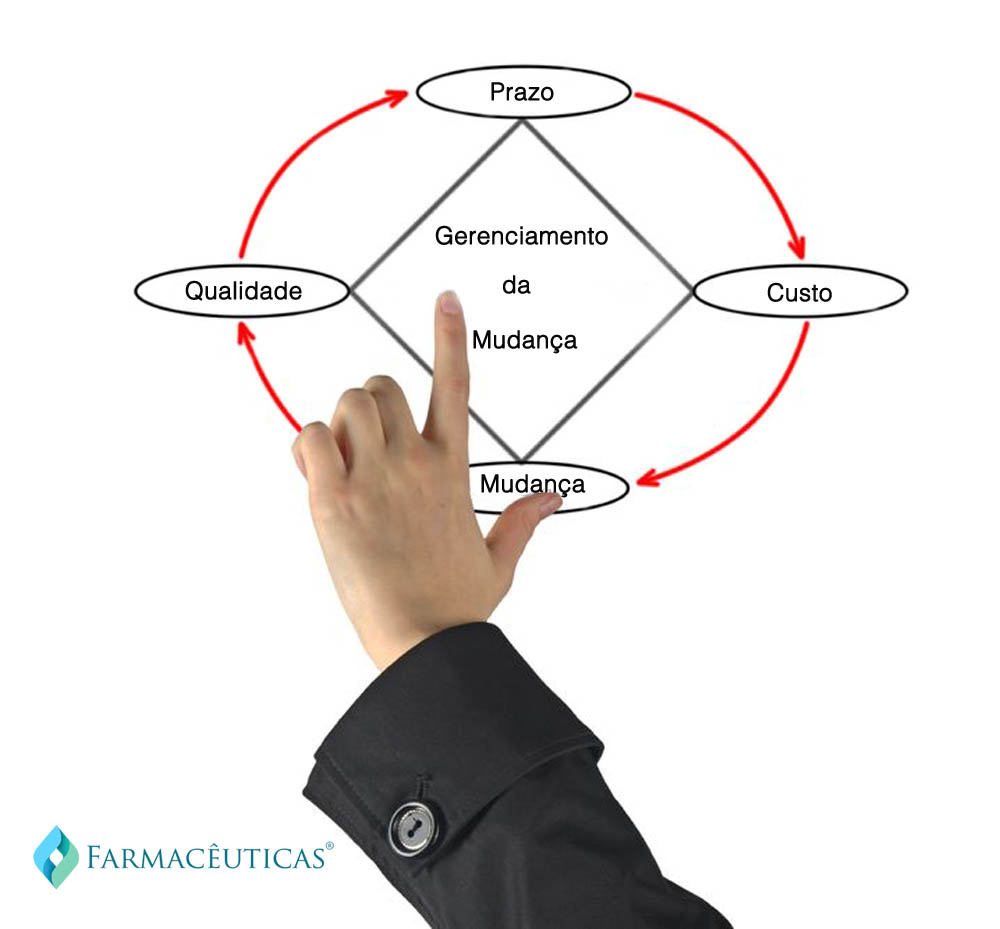
Impacto das mudanças
Em caso de mudanças, o impacto gerado pode afetar os seguintes sistemas, requisitos e órgãos reguladores:
- Qualidade do produto
- Custo
- Prazo
- Projeto
- Sistema da qualidade
- Documentação
- Processos produtivos
- Estudo de estabilidade
- Validação
- Qualificação
- BPF/GMP
- Indicadores da qualidade
- Requisitos legais (RDCs – ANVISA)
- Registro do produto na ANVISA (regulatórios)
- ISO 9001
- ISO 14001
- Autorizações e licenças da Prefeitura
- Autorizações e licenças da Vigilância Sanitária (ex. LTA e Autorização de funcionamento expedida pela Vigilância Sanitária)
- Corpo de Bombeiros
- Saúde do paciente
- EHS (Environment, Health and Security)
- Treinamento
Tais impactos podem ser:
Direto: quando a mudança tem impacto direto podendo infringir alguma Norma, Órgão regulador, ou impactar diretamente na qualidade do produto.
Indireto: quando a mudança tem impacto indiretamente em alguma Norma, Órgão regulador, ou na qualidade do produto.
Alterações relevantes em termos de qualidade podem afetar diversas áreas de uma empresa (por ex: GQ, Assuntos regulatórios, Produção, Controle de Qualidade, Engenharia/Manutenção, P&D e Departamento Comercial); portanto, o controle deve ser uma tarefa na qual toda a empresa deve estar envolvida e comprometida.
Implantação do controle de mudanças
A fim de introduzir com êxito um programa de controle de mudanças, é essencial que haja o apoio dos gestores e da alta administração da empresa, ou seja, a implantação da sistemática somente terá êxito se vier de “cima para baixo”.
O programa também necessita de uma instrução correspondente para gestão da qualidade.
Estrutura do programa de controle de mudanças:
- Missão e definição do gerenciamento da qualidade
- Equipe de controle de mudança
- Definição das diretrizes que envolvem a sistemática de controle de mudanças (POP)
- Change Request ou formulário de solicitação de mudança
- Gerenciamento da mudança
Para facilitar a implantação da sistemática, pode ser utilizado um software específico para registro e gerenciamento das mudanças, no entanto, tal software deve ser validado e os envolvidos devem ser devidamente treinados antes de sua utilização.
Change request e gerenciamento de controle de mudança
Um protocolo/formulário de gerenciamento de mudanças, mais conhecido como Change Request, deve descrever as alterações específicas a serem realizadas.
É uma etapa de abordagem e avaliação das alterações, permitindo uma avaliação antecipada da estratégia para a execução da mudança, seus decorrentes impactos e ações.
De forma geral, as informações que devem conter um formulário de solicitação de mudança são:
- Descrição detalhada da mudança
- Classificação da mudança
- Número do registro da mudança
- Justificativa da necessidade da mudança com racional (descrição da causa e motivo).
- Local da mudança
- Áreas relacionadas
- Prazos
- Referências cruzadas
- Avaliação do impacto da mudança
- Avaliação do risco (risk assessments) na qualidade do produto feita pelos gestores envolvidos de todos os setores, incluindo a identificação dos potenciais riscos e estratégia detalhada de como estes riscos serão mitigados ou gerenciados;
- Custos relacionados
- Fases de implantação da mudança, quando aplicável
- Discussões (reuniões) sobre a adequação da estratégia de controle aprovado para identificar e gerir estes riscos e, se necessário, a descrição dos controles adicionais.
- Descrição dos estudos a serem realizados, os métodos de ensaio e critérios de aceitação que serão utilizados para avaliar plenamente o efeito da alteração proposta no produto.
- Justificativas dos métodos propostos para avaliar o impacto da mudança.
- Avaliação da necessidade de produção de lote piloto em caso de alterações de formulação, etapas produtivas e de parâmetros de produção.
- Plano de estudo de estabilidade, quando aplicável.
- Avaliação do impacto na qualificação e validação (limpeza, processo e metodologia analítica)
- Avaliação da abrangência da mudança proposta, em caso de impacto em outros processos produtivos.
- Avaliação de impacto em Normas e Órgãos Reguladores.
- Descrição das responsabilidades.
- Descrição dos documentos a serem elaborados/revisados.
- Descrição das ações (corretivas e preventivas) propostas.
- Nome e data do responsável pela abertura do formulário.
- Nome e data do responsável pela revisão do formulário.
- Nome e data do responsável pela aprovação do formulário.
- Aprovação dos responsáveis.
- Lições aprendidas.
- Acompanhamento das ações e respectivos prazos.
- Conclusão da mudança.
- Monitoramento da mudança.
Unificação dos diversos programas de controle de mudança
No passado, as empresas não reconheciam a necessidade de controle de mudanças como uma atividade de garantia de qualidade.
Era comum que cada departamento desenvolvesse sistemas paralelos de controle de mudanças.
Programas de controle de mudanças independentes podem gerar uma avaliação parcial do impacto de uma mudança e seus respectivos riscos.
Desta forma, a unificação da sistemática e treinamento de todos os setores na atividades faz-se necessário.
Desvios
Os desvios não devem ser tratados como mudanças. Um desvio é uma variação não planejada e indesejável de um requisito.
Não corresponde com o objetivo e o procedimento de controle de mudanças e deve ser tratado de acordo com o procedimento específico de desvios.
De que maneira a mudança deve ser considerada como implementada?
Após a conclusão de todas as ações previstas no change request, incluindo todos os estudos e elaboração/revisão de documentos e suas respectivas aprovações, deve ser feito um levantamento para assegurar que tais ações foram feitas de maneira eficaz.
Os prazos previamente definidos devem ser cumpridos.
Após a comprovação da execução de maneira eficiente de todas ações, a mudança pode ser considerada como concluída e implementada.
Gerenciamento de mudanças após aprovação
É altamente recomendável que as empresas realizem um gerenciamento da mudança após aprovação.
Para tanto, deve ser feito um monitoramento para avaliar se as mudanças foram viáveis e se as ações executadas foram eficazes.
O monitoramento pode ser feito através do follow-up das seguintes informações:
- Feedback dos setores envolvidos;
- Avaliação dos indicadores da qualidade;
- Avaliação de desvios decorrentes da mudança;
- Reclamações de mercado;
- OOS – Out of Specification – produto fora de especificação
Periodicamente deve ser feito um relatório contendo as informações decorrentes do monitoramento das mudanças.
Pode haver mais de um tipo de mudança em um mesmo protocolo?
É possível abranger mais de uma mudança de um único protocolo, desde que eles estejam diretamente relacionados e uma avaliação simultânea em um protocolo/formulário único seja significativo.
A justificativa deve ser descrita no Change Request.
Dependendo da natureza da alteração, também é possível que o conteúdo de um formulário seja aplicado em mais de uma situação. No entanto, este dependerá se a aplicação foi eficaz na ocasião.
Deve ser aberto um protocolo de controle de mudança para qualquer alteração?
Protocolos de Gerenciamento de Mudanças são aplicáveis a todos os tipos de alterações, independentemente da abordagem de desenvolvimento.
No entanto, o mais usual é que o controle de mudança seja aplicado quando a mudança esteja relacionada com algum item de Boas Práticas de Fabricação.
Consultoria para implantação da sistemática de Controle de Mudanças
Caso necessite de ajuda para a implantação ou adequação da sistemática de Controle de Mudança (Change Control) de sua empresa entre em contato com a Consultoria Farmacêuticas:
Contato Consultoria Farmacêuticas
Fernanda de Oliveira Bidóia
Diretora Técnica
Telefones:
Comercial + 55 11 3392 2424
Celular: + 55 11 992961326
End: Av. Marquês de São Vicente, 446 cj 1102
São Paulo – SP
Referências
EMA Questions and Answers on Post Approval Change Management Protocols – 2012
FDA – Pharma Change Control – Strategies for Successful Company-Wide Implementation – 2013
ANVISA – Guias Relacionados à Garantia de Qualidade – 2006
ANVISA – RDC n° 17/2010
ANVISA – RDC n° 47/2013
ANVISA – RDC n° 48/2013
ANVISA – RDC n° 13/2014
ANVISA – RDC n°34/2015
















Olá equipe farmacêuticas.
A área de atuação de vocês ė somente com consultoria, ou vocês também possuem sistemas informatizados apoiadores para o processos de Change Control, Desvios de qualidade, entre outros?
Oi, Wagner!
Apenas atuamos com cursos e consultoria. Não fazemos representação de softwares de gestão da qualidade. Mas agradeço pelo interesse!
Abs,
[…] Garantia da Qualidade – Controle de Mudanças […]
[…] Conhecimento teórico e prático na atividade – Garantia da Qualidade (Controle de Mudança) […]