Diante da publicação da Resolução nº 301, pela ANVISA, em 21 de agosto de 2019, que dispõe sobre as Diretrizes Gerais de Boas Práticas de Fabricação de Medicamentos, um novo cenário em relação ao processo de Validação de Limpeza tem gerado muitas dúvidas aos profissionais da indústria farmacêutica.
Segundo a nova Resolução (RDC 301/2019), novos processos devem ser implementados para avaliar e controlar aos riscos de contaminação cruzada apresentados pelos produtos farmacêuticos.
Dentre estes novos processos, a avaliação toxicológica dos insumos farmacêuticos ativos (IFAs) produzidos deverá ser realizada.
Na fabricação de medicamentos no exterior, a avaliação toxicológica das IFAs já é exigência dos órgãos regulamentadores, desde 2015, como publicado pelo EMA e FDA. Buscando se equiparar ao mercado internacional, a ANVISA, aumentou o grau de exigência em relação a avaliação toxicológica e a importância de um profissional capacitado, um toxicologista com experiência comprovada para atuação nesse seguimento (conforme consta no artigo 369 da RDC 301/2019).
Uma das ferramentas para a avaliação toxicológica dos insumos farmacológicos ativos produzidos é o estabelecimento da Exposição Diária Permitida (PDE- Permitted Daily Exposure).
O quê é o PDE?
O PDE representa a dose específica de uma substância que improvavelmente causaria um evento adverso em um indivíduo exposto diariamente por toda a sua vida, ou seja, é a dose na qual a população pode ser exposta à substância sem que haja riscos à saúde.
De acordo com a nova Resolução (RDC 301/2019), as determinações dos valores de Exposição Diária Permitida (PDE) dos produtos irão subsidiar as reavaliações dos limites residuais máximos permitidos carreados entre produtos, no que tange às validações dos procedimentos de limpeza de superfícies de equipamentos em contato com os produtos.
O estabelecimento do valor de PDE, que é um limite baseado em saúde (health based limits – HBL) é o ponto de partida para traçar estratégias eficientes para prevenção e controle da contaminação cruzada, com base no risco real, auxiliando na estruturação dos Sistemas de Qualidade Farmacêutica e Gerenciamento de Risco.
Parece simples, mas para a elaboração do cálculo e definição do PDE é necessário uma busca científica estruturada e interpretação dos dados encontrados nos estudos toxicológicos, que proporcionem a escolha correta das doses e fatores a serem considerados.
São utilizados dados farmacológicos e toxicológicos de estudos não clínicos e clínicos. Algumas abordagens alternativas são aceitáveis, desde que bem justificadas cientificamente.
A atuação do toxicologista é fundamental, pois a escolha e interpretação dos dados clínicos e toxicológicos requer conhecimento científico e experiência profissional.
Cálculo de PDE
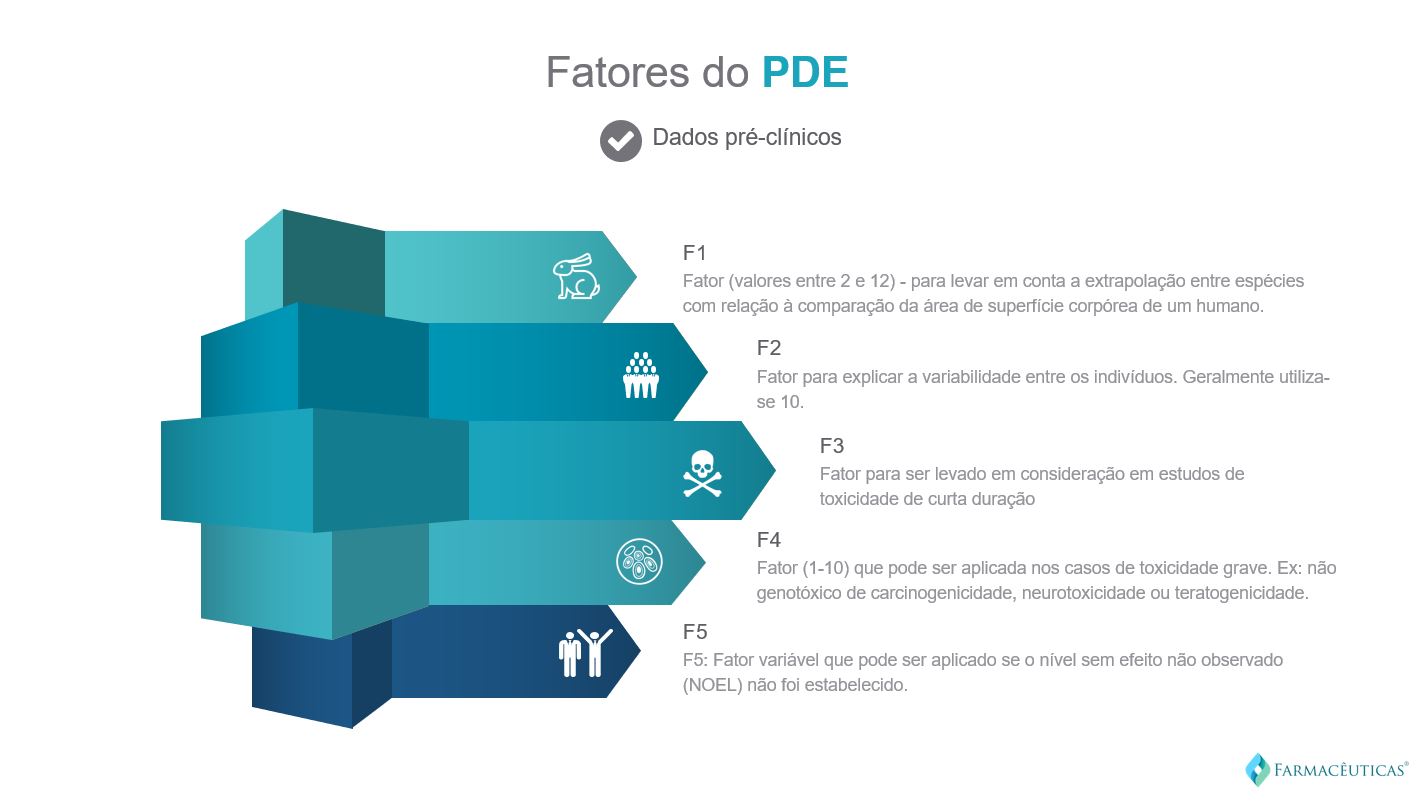
Para estabelecimento do valor de PDE é necessário conhecer o valor de NOAEL para a substância em questão e determinar os fatores de incerteza (F1; F2;F3;F4;F5). O PDE é estabelecido através do seguinte cálculo:
Onde:
Peso padrão = Peso padrão do humano adulto = 50 Kg
Peso padrão = Peso padrão do animal= 1 Kg
NOAEL = Nível de efeito adverso não observado (mg/Kg de peso/dia) – estudos de toxicidade
NOEL = Nível de efeito não observado (mg/Kg de peso/dia) – estudos de toxicidade
Quando o cálculo for em humanos extrapolar o valor por meio do cálculo de HED.
F: Fator de incerteza (ajuste)
A determinação do cálculo de PDE envolve diferentes etapas:
- Identificação do perigo através de dados relevantes;
- Identificação de efeitos críticos/adversos;
- Determinação do NOAEL a partir dos efeitos críticos observados;
- Uso de fatores de ajuste para contemplar incertezas
Essas etapas são elementos importantes na tomada de decisão, para a correção e adequação de parâmetros, já que temos diferentes cenários em nosso país e no mundo, no que diz respeito à plantas distintas, nem sempre atualizadas, fluxos diversos, etc.
Etapas para a determinação do PDE
Etapa 1 do cálculo de PDE – Identificação do risco
A primeira etapa consiste na Identificação do Perigo. O conceito de perigo de uma substância química envolve características intrínsecas à mesma. Vale ressaltar que o conceito de Risco está relacionado com o perigo e a exposição à substância química (Risco = Perigo x Exposição). Para alcançar um bom Gerenciamento do Risco faz-se necessário o conhecimento do perigo (toxicidade da substância química) e as condições de exposição ao composto.
Nesta etapa é necessária uma avaliação qualitativa das propriedades inerentes (toxicidade) de uma substância que se correlaciona com a sua capacidade em produzir em efeito nocivo. A caracterização do perigo é realizada através de estudos toxicológicos, sendo necessária a busca de informações provenientes de dados não clínicos (estudos de toxicidade de doses repetidas, genotoxicidade in vitro e in vivo, carcinogenicidade, toxicidade reprodutiva e do desenvolvimento) e dados clínicos (efeitos terapêuticos e efeitos adversos).
Todos os estudos disponíveis na literatura científica e base de dados disponíveis devem ser avaliados. Dependendo do estágio de desenvolvimento de uma molécula, alguns dados podem não estar disponíveis, o que irá impactar no estabelecimento do PDE.
O impacto da indisponibilidade de dados para completar a etapa de identificação do perigo deve ser avaliado criticamente, por um toxicologista, de modo a garantir que limites seguros sejam estabelecidos.
Etapa 2 do cálculo de PDE – evento adverso crítico
Na segunda etapa, a identificação de efeito crítico/adverso deve incluir o indicador mais sensível de um efeito adverso observado nos estudos não-clínicos; também inclui efeitos clínicos, terapêuticos ou adversos. A partir dos efeitos críticos observados é feita a determinação do NOAEL (No Observed Adverse Effect Level), cuja definição é a dose na qual nenhum efeito adverso é observado. Esses valores são definidos a partir de estudos com doses repetidas, estudos subcrônicos ou crônicos realizados com a substância.
Para algumas substâncias químicas, encontramos um NOAEL para cada efeito adverso/crítico, os quais devem ser considerados para efeito de cálculo.
Quando encontramos na literatura científica, estudos que apresentam valores de NOAEL diferentes para o mesmo estudo, o que fazer? Qual delas usamos para calcular o PDE?? Se o mesmo efeito é observado em vários estudos, temos que considerar a menor dose para efeito de cálculo.
Em muitos casos, como por exemplo, para insumos fitoterápicos, podemos não encontrar valores de NOAEL. Nessas situações podemos empregar outros dados disponíveis, como o LOAEL (Lowest Observed Adverse Effect, que corresponde a menor dose estabelecida na qual observa-se um efeito adverso, e pode ser utilizado na ausência de um NOAEL. No entanto, para o emprego desses outros parâmetros toxicológicos, a avaliação de um profissional capacitado é fundamental.
Etapa 3 do cálculo de PDE – Fatores de ajustes
Para estabelecimento do PDE é necessária a aplicação de fatores de ajuste, que também são chamados de fatores de segurança, incerteza ou modificadores. Tais fatores levam em consideração as incertezas e permitem a extrapolação para um nível confiável e robusto que não provoque efeito na população humana.
O PDE é derivado dividindo o NOAEL para o efeito mais crítico por fatores de ajuste, apresentados abaixo:
A Extrapolação entre Espécies (F1) leva em consideração a área superficial comparativa, razões de peso corpóreo para a espécie em questão e para o homem.
Para a variabilidade entre indivíduos (F2) considera-se um valor fixo (F2=10).
A extrapolação por duração da exposição (F3) leva em consideração a toxicidade em estudos com um curto período de exposição. Os valores a serem empregados são definidos de acordo com o tempo de duração do estudo e a espécie animal utilizada. Os estudos devem ser realizados, se possível, por aproximadamente 70% da vida do animal. Estudos por períodos mais longos e número considerável de animais no estudo podem apresentar dados mais robustos.
Os fatores relacionados as considerações sobre toxicidade grave (severa) (F4) devem ser aplicados nos casos em que toxicidade grave for reportada para a substância, como por exemplo: carcinogenicidade não genotóxica, neurotoxicidade ou teratogenicidade. Para estudos de Toxicidade Reprodutiva, os seguintes fatores são aplicáveis:
Quando encontrados estudos em que vários efeitos críticos/adversos sejam identificados, deve-se justificar a escolha do mais adequado. Essa escolha deve ser feita de forma criteriosa e o olhar do toxicologista fundamental. Como padrão, o menor valor de PDE será utilizado.
Etapa 4 do cálculo de PDE – O PDE e a farmacologia
O objetivo do cálculo do PDE é garantir a segurança de seres humanos expostos ao insumo farmacêutico ativo, seja pela contaminação cruzada durante a produção do medicamento ou através da exposição ocupacional, dos manipuladores, por exemplo. Sendo assim, se dados clínicos em humanos estiverem disponíveis e forem fidedignos, eles são altamente relevantes nesse processo.
Quando o efeito mais crítico é baseado em dados obtidos em humanos, e não em animais, o cálculo do PDE com base nos dados de estudos animais pode ser inapropriado e uma avaliação específica para a substância com base nos dados clínicos deve ser realizada para este propósito. Também é importante levar em consideração qual o nível da substância em questão é associado com efeitos adversos na prática clínica.
O PDE, normalmente, é derivado de estudos realizados pela mesma via de administração para a qual pretende-se usar o medicamento. No entanto, nem sempre encontramos valores de NOAEL para todas as vias de administração. Em alguns casos, uma via de administração diferente pode ser requerida e aplicável, de modo que ocorra uma diferença de biodisponibilidade.
Neste caso, é aconselhável a avaliação da via de administração não só do produto em estudo mas também dos produtos subsequentes produzidos nos compartilhamentos compartilhados, em um cenário de possível contaminação cruzada.
Uma vez que a biodisponibilidade pode variar significativamente entre espécies, a extrapolação de dados de uma via de administração para outra deve ser feita com base em dados obtidos em humanos.
A biodisponibilidade deve ser considerada e o toxicologista deve avaliar os estudos disponíveis para conduzir a escolha dos melhores dados para definição do PDE.
Para alguns insumos farmacêuticos ativos é necessária abordagem diferenciada, merecendo atenção especial para estabelecimento do PDE, devido às particularidades apresentadas. São eles:
- IFAs com potencial genotóxico,
- IFAs com potencial altamente sensibilizantes,
- Macromoléculas e peptídeos terapêuticos,
- Produtos Medicinais Investigacionais (em fase de desenvolvimento, cujos dados toxicológicos ainda são limitados)
Conclusão
De acordo com o exposto, fica claro que a avalição toxicológica do insumo farmacêutico ativo é bem mais abrangente. Para que seja definido o valor de PDE deve ser realizada uma busca compreensiva na literatura científica, os dados e resultados encontrados devem ser documentados, as fontes originais dos estudos devem ser consultadas e devidamente referenciados. O fruto de toda essa pesquisa é a elaboração de um relatório, no qual deve constar os dados encontrados e todo o racional par escolha das doses e outros parâmetros. Esse relatório deve ser elaborado e revisado por um profissional toxicologista, capacitado, que possua experiência, para atender as novas exigências, sempre colaborando para a melhoria das boas práticas de fabricação de medicamentes e visando garantir a saúde dos indivíduos expostos.
Vale ressaltar que o valor obtido por meio do cálculo de PDE não é o limite de validação de limpeza. O profissional deve saber inserir este valor, dentro dos critérios estabelecidos para o estudo, dentro dos cálculos já conhecidos de validação de limpeza.
Somente após a inserção é possível verificar se o novo limite encontrado está acima ou abaixo dos valores obtidos por meio da mínima dose ou 10 ppm.
Lembrando que se o novo limite for menor, a validação de limpeza existente deve ser considerada como perdida e um novo estudo deve ser imediatamente iniciado.
Elaboração de relatório de PDE
Visto a complexidade da avaliação dos dados a contratação de profissionais especializados faz-se necessária.
Neste sentido, a Consultoria Farmacêuticas oferece às indústrias farmacêuticas a opção de contratação de serviço personalizado para elaboração de relatórios de PDE de forma individualizada com exclusividade para o medicamento e sua correlação aos demais medicamentos do portfólio da empresa.
Nosso diferencial é a emissão de um relatório robusto e exclusivo, além da instrução de como aplicar os valores calculados nos diversos cases de validação de limpeza.
Entre em contato e faça um orçamento sem compromisso.
Consultoria Farmacêuticas
contato@farmaceuticas.com.br
Referências
- RDC nº 301/2019 – Boas práticas de Fabricação de medicamentos
- FDA Guide to Inspections Validatios of Cleaning Processes
- EMA, Guideline on setting health-based exposuer limits for use in risk identification in teh manufacture of different medicinal products in shared facilities -2014
- PIC/s- Guideline on setting health based exposure limits for use in risk identification in the manufacture of diferente medicinal products in shared facilities, PI046-1 Annex, 1 July 2018.